Questo articolo presenta una serie di esperienze che costituiscono un percorso sull’elettrochimica così articolato:
- un esempio di reazione redox con scambio di elettroni;
- la scoperta sperimentale di reazioni redox spontanee e non spontanee;
- la produzione di corrente elettrica come risultato di semi reazioni redox che avvengono in spazi separati connessi a formare un circuito chiuso nel quale circolano gli elettroni, le pile;
- la costruzione di batterie mettendo più pile in serie;
- la trasformazione dell’energia elettrica in radiazione luminosa connettendo alle batterie diodi ad emissione luminosa (LED);
- la costruzione di pile in cui i conduttori e la soluzione elettrolitica sono rispettivamente il nostro corpo e il nostro sudore;
- l’osservazione dei fenomeni di trasformazione luce-energia elettrica, flusso di elettroni spontaneo e accumulo di energia nei sistemi viventi, ovvero gli eventi fotochimici e le catene di reazioni redox dei processi fotosintetici, l’accumulo dell’energia sotto forma di molecole stabili come gli zuccheri.
A questo link è disponibile il protocollo completo da 0 a pila in 7 passi autogestiti, si può condividere il link con i propri studenti, scaricare il protocollo completo in formato PDF oppure scaricare in formato testo e modificare.
A questo secondo link il protocollo in italiano e in inglese per la sola misura della costante di Planck, consigliato per le classi 3 del liceo scientifico.
Il contesto didattico
L’esperienza complessiva, così come viene presentata in questo post e nel protocollo scaricabile, è stata messa a punto con la collaborazione di un gruppo di studenti interessati ed è stata proposta durante una autogestione e una mostra scientifica con postazioni interattive.
L’esperienza è stata pensata per essere accessibile a studentesse e studenti con diversa preparazione di base e diversa abitudine alla pratica laboratoriale, ed è stata condotta preparando postazioni e schede sperimentali che consentissero l’apprendimento autonomo partendo da una esperienza semplice da realizzale e per la quale fosse possibile pensare e sperimentare varianti insieme ai propri compagni. Gli studenti fruitori hanno lavorato in gruppi portando avanti i protocolli in autonomia, mentre gli studenti più esperti che avevano contribuito alla messa a punto dell’esperienza, erano a disposizione per aiutare i compagni a ragionare su quanto osservavano e misuravano.
Ogni gruppo porta avanti l’intera esperienza, completa dei 7 passaggi, in circa 2 ore.
Noi abbiamo preparato 4 postazioni per ciascuna esperienza, abbiamo fatto iniziare 4 gruppi che lavoravano in contemporanea e li abbiamo fatti procedere spostandosi verso le postazioni con le esperienze successive mano a mano che terminavano le precedenti. I posti liberi venivano subito occupato da 4 nuovi gruppi di lavoro.
Per una trattazione più approfondita dell’argomento, è possibile proporre ciascuna delle 7 esperienze in diversi anni di corso, partendo dalla classe 3 di un liceo scientifico e fino alla classe 5 costruendo un percorso sull’elettrochimica. Ciascuna esperienza, in questo caso, viene proposta in concomitanza con la trattazione degli argomenti ad essa correlati e i protocolli da proporre vengono strutturati in modo tale che gli studenti riflettano con più autonomia sui temi, grazie a fogli risposte con domande guida. In questo caso inoltre, la trattazione deve prevedere di trattare anche gli aspetti quantitativi delle differenze di potenziale elettrochimico delle specie coinvolte.
Le esperienze sperimentali per immagini per farsi una idea della proposta in pochi minuti
esperienza 1: sistema redox semplice con reazione spontanea, scambio di elettroni secondo potenziale redox, formazione di una nuovo metallo e dissoluzione di un metallo in forma ionica solubile in acqua.
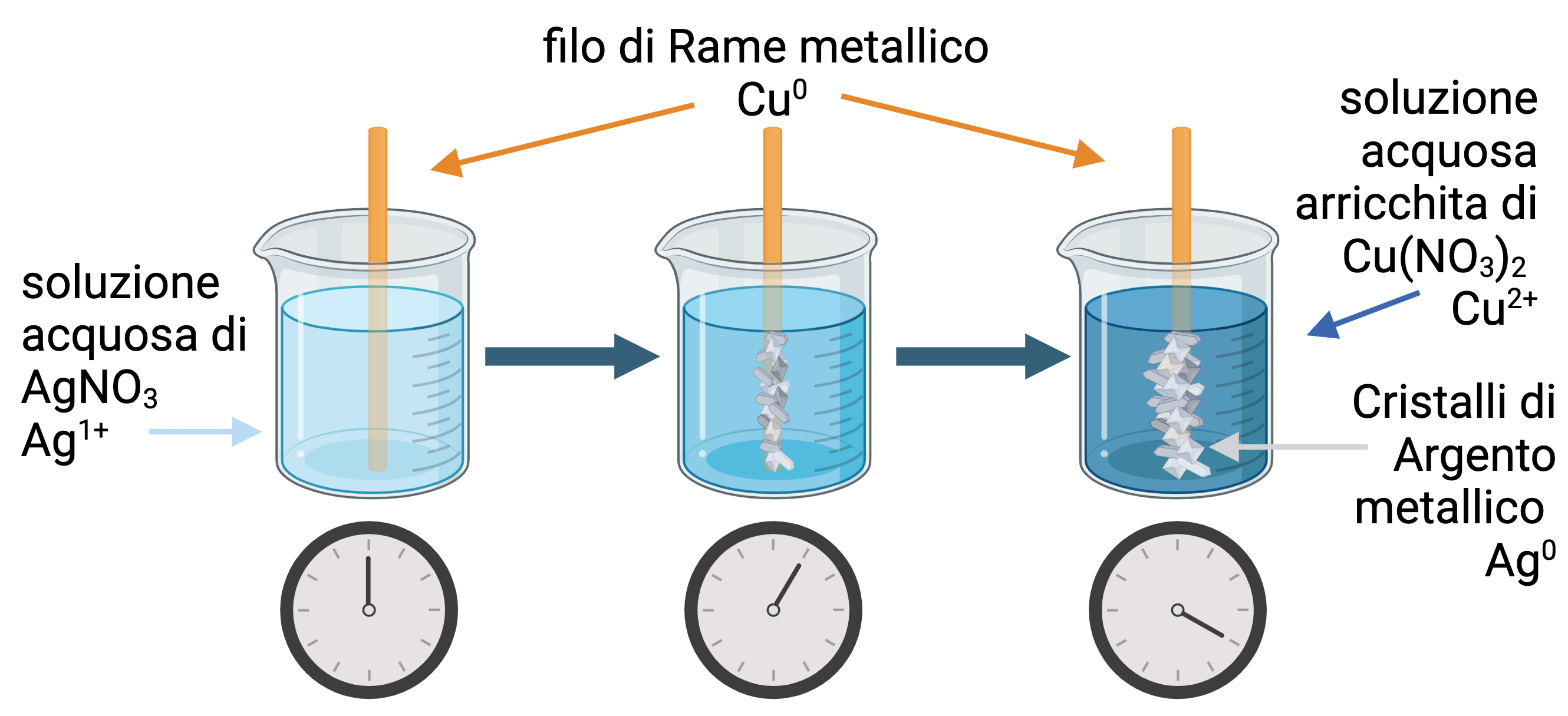
Scambi di elettroni tra Rame e Argento:
La reazione che osserviamo è Cu(s) + 2 AgNO3 (aq) → Cu(NO3)2 (aq) + 2 Ag (s)
Immergiamo un filo di rame in una soluzione incolore di nitrato di argento.
In questa situazione, in accordo con il potenziale redox dei due metalli, il rame metallico dovrebbe cedere i suoi elettroni e diventare uno ione in soluzione acquosa, mentre lo ione argento può prendere gli elettroni e formare il metallo solido.
Lo ione rame in soluzione acquosa assume un colore blu di tonalità scura, l’intensità della colorazione della soluzione aumenta all’aumentare della concentrazione dello ione rame in acqua. Le soluzioni acquose di Ag1+ sono incolori, ma l’argento metallico che si forma ha una organizzazione microcristallina visibile.
esperienza 2: determinazione sperimentale della direzione spontanea del flusso di elettroni in un sistema redox rame-zinco
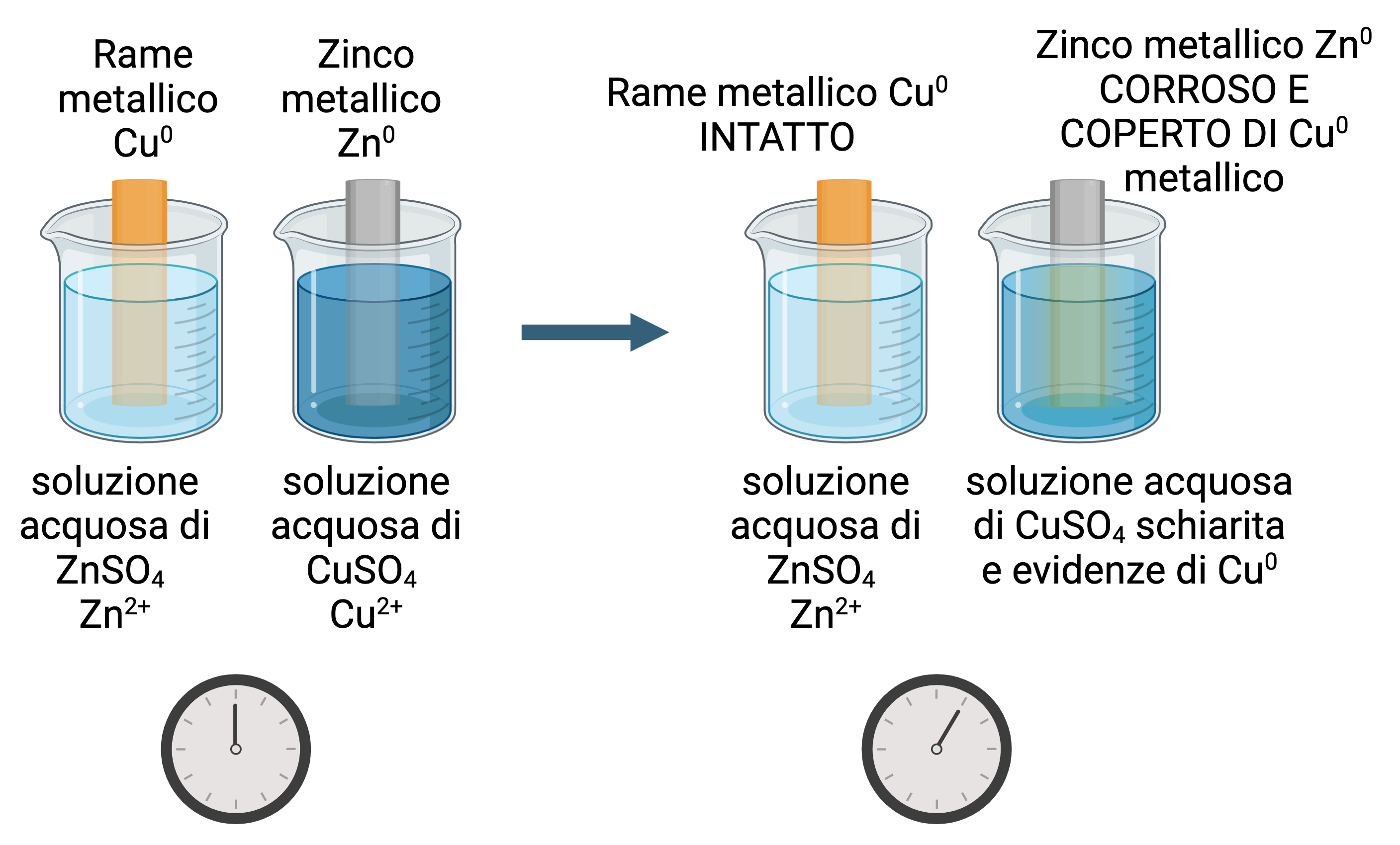
Determinazione della direzione spontanea del flusso di elettroni tra rame e zinco
esperienza 3: costruzione di una pila di Daniell con semireazioni redox separate e costruzione di un circuito chiuso usando un sistema redox rame-zinco
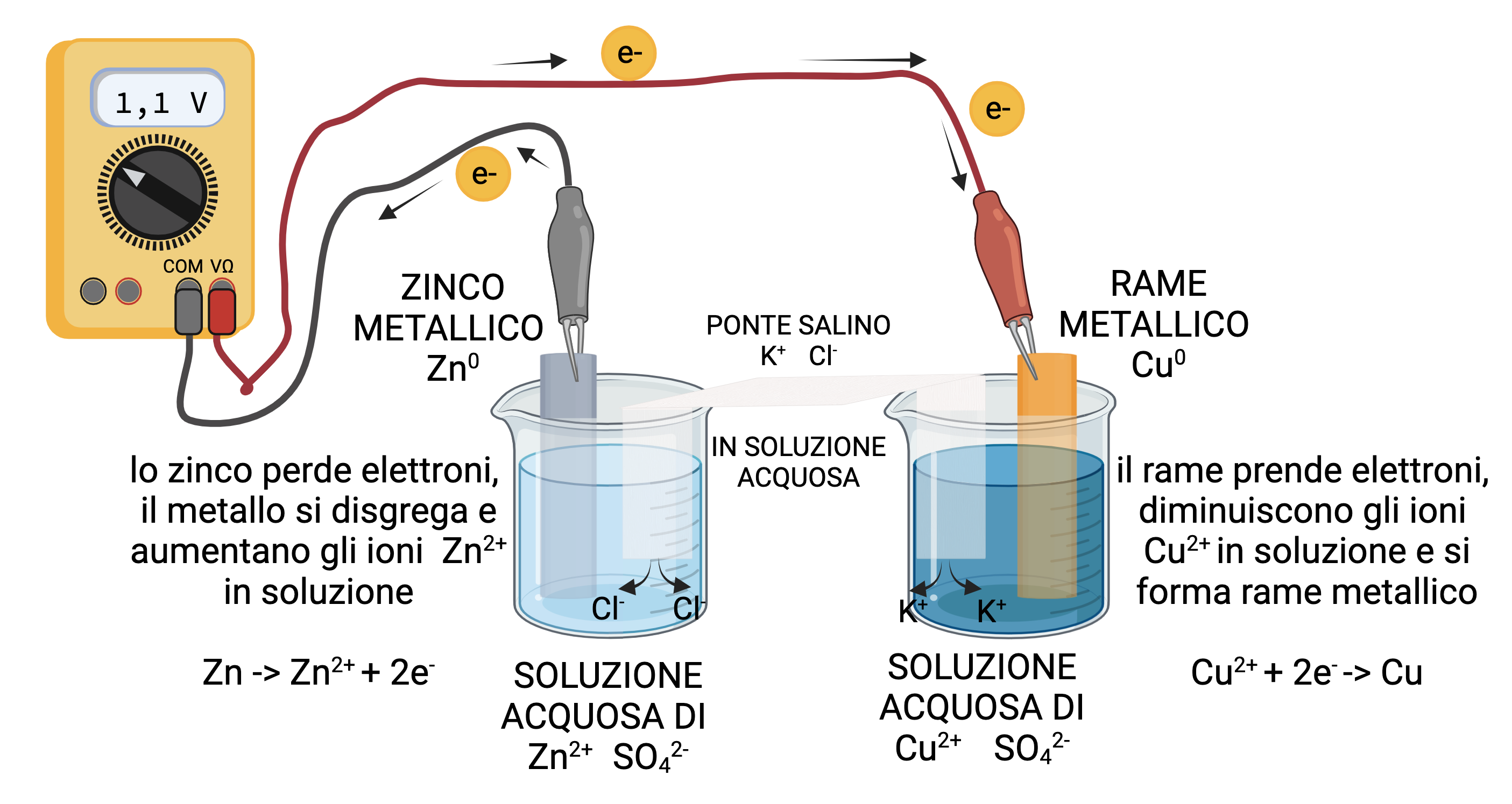
Costruiamo una pila con il sistema redox Rame-Zinco separando fisicamente nello spazio le due semireazioni di ossidazione dello zinco e riduzione del rame e connettendo i due ambienti attraverso il ponte salino di una soluzione elettrolitica e i cavi elettrici che consentono il flusso degli elettroni da un metallo all’altro. La differenza di potenziale generata,
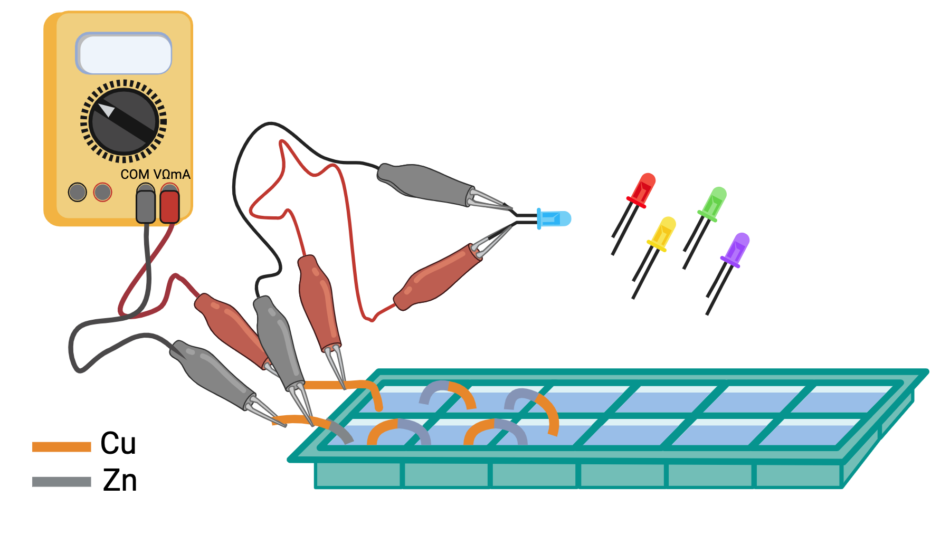
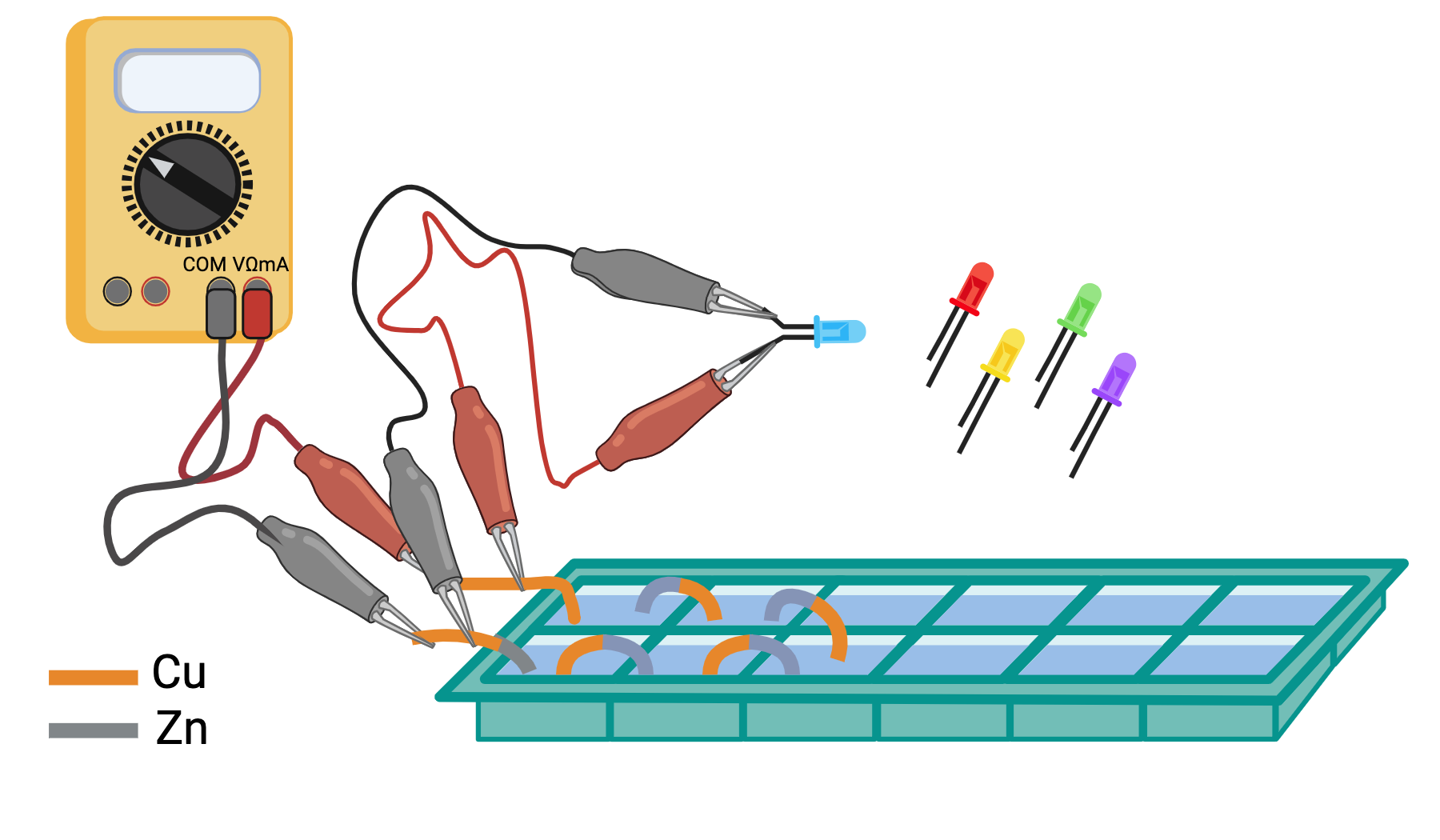
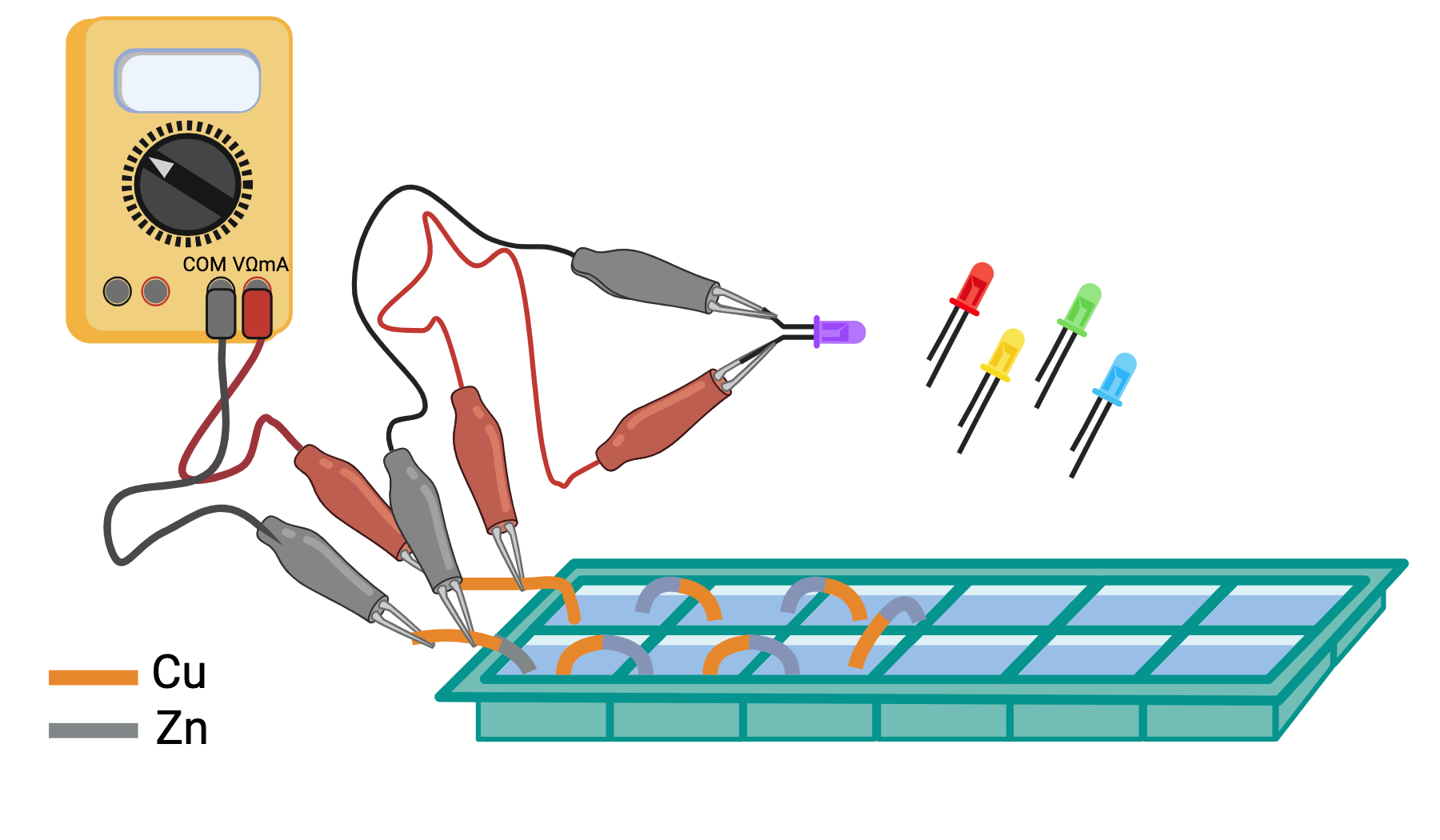
esperienza 4: costruzione di una batteria mettendo più pile in serie e misura della differenza di potenziale prodotta dalla batteria al variare del numero di pile
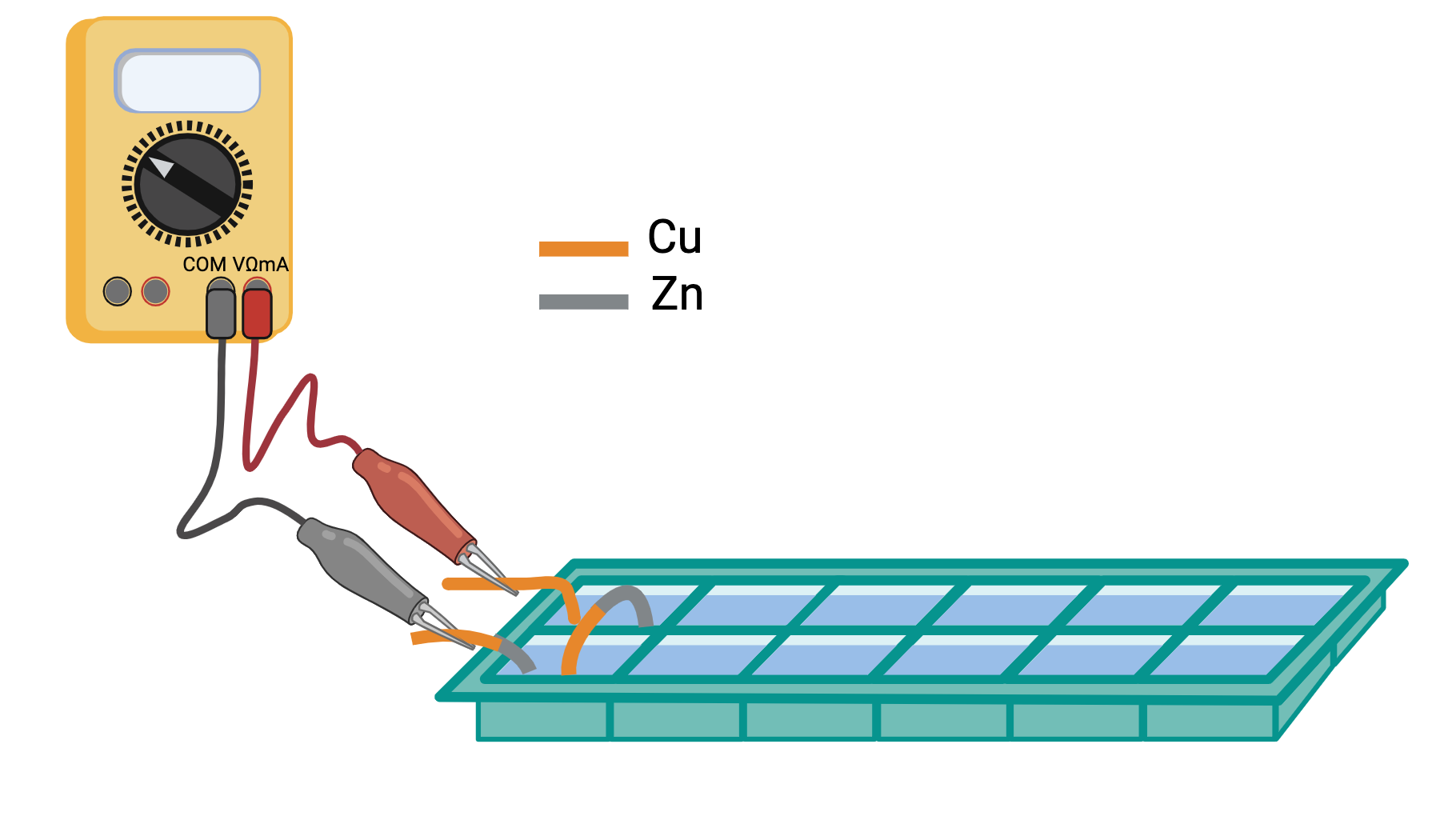


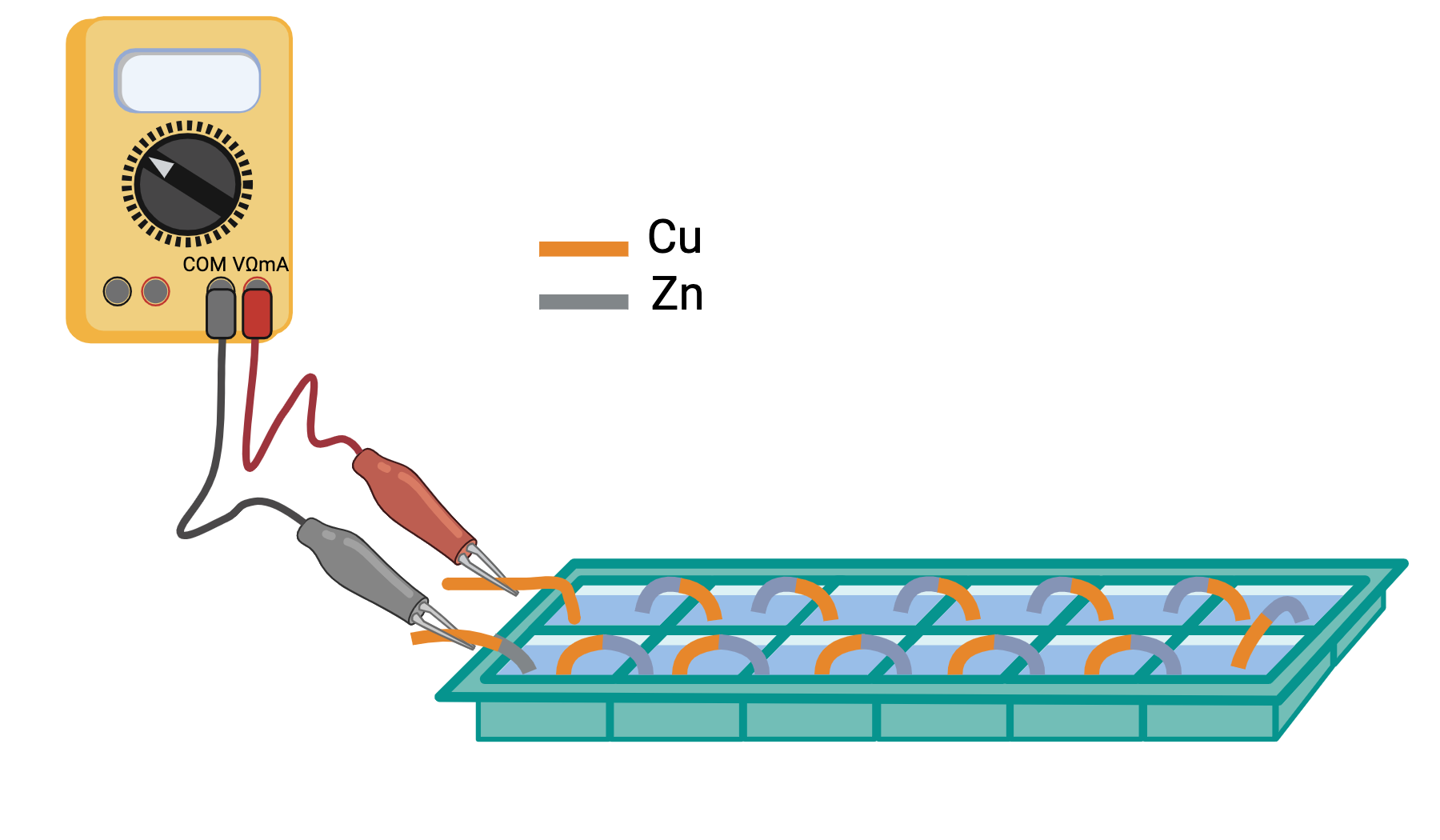
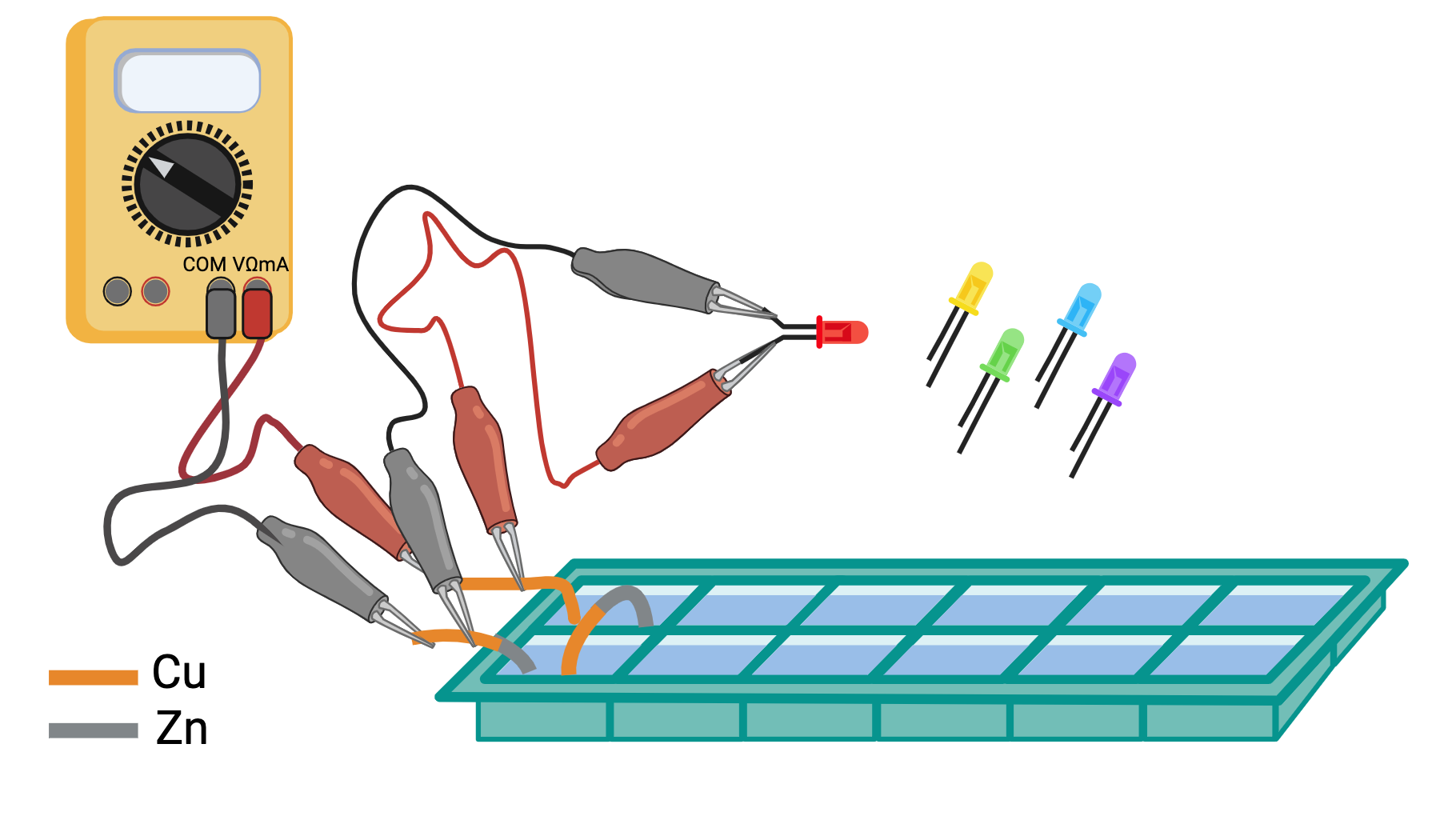
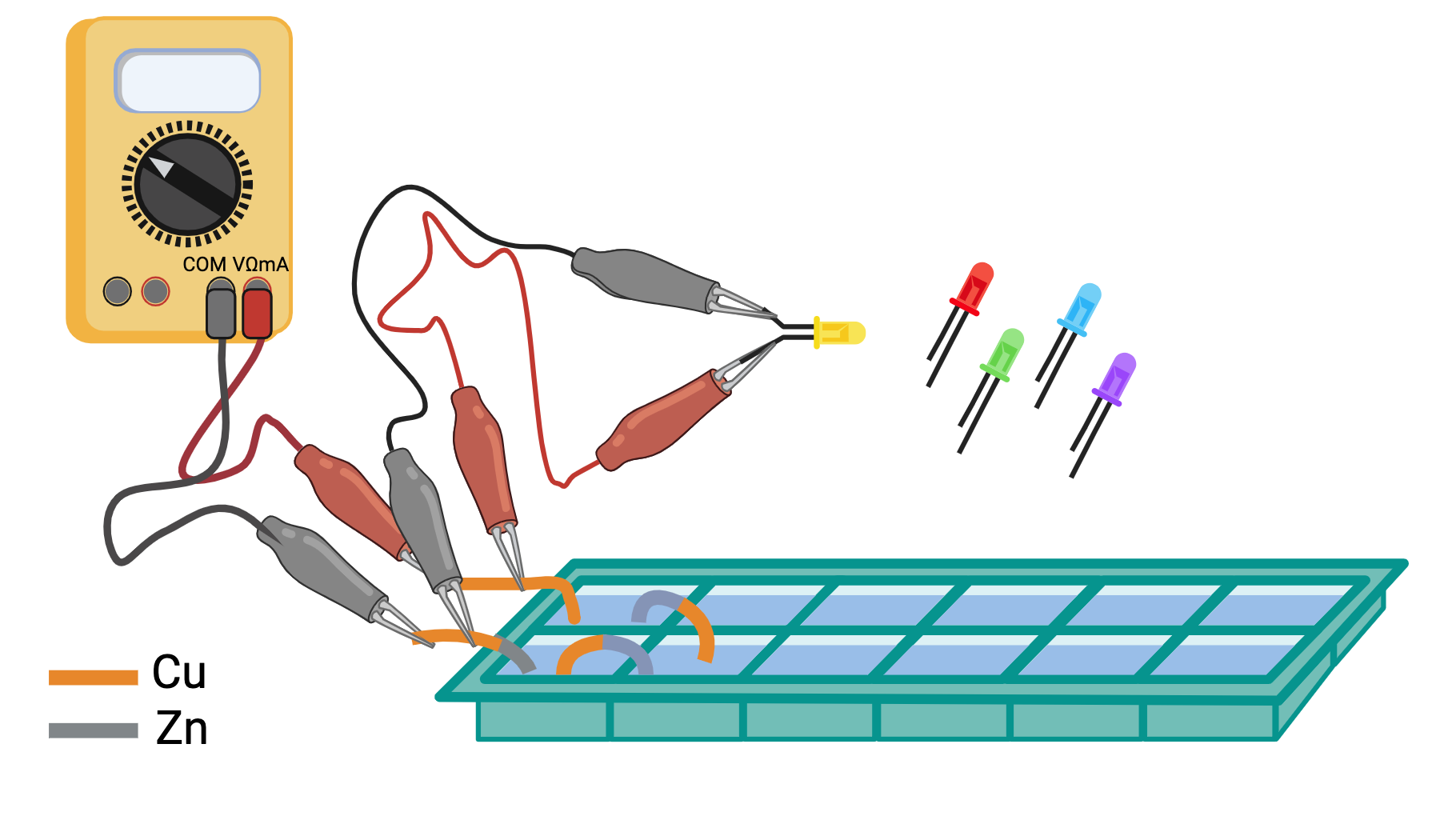
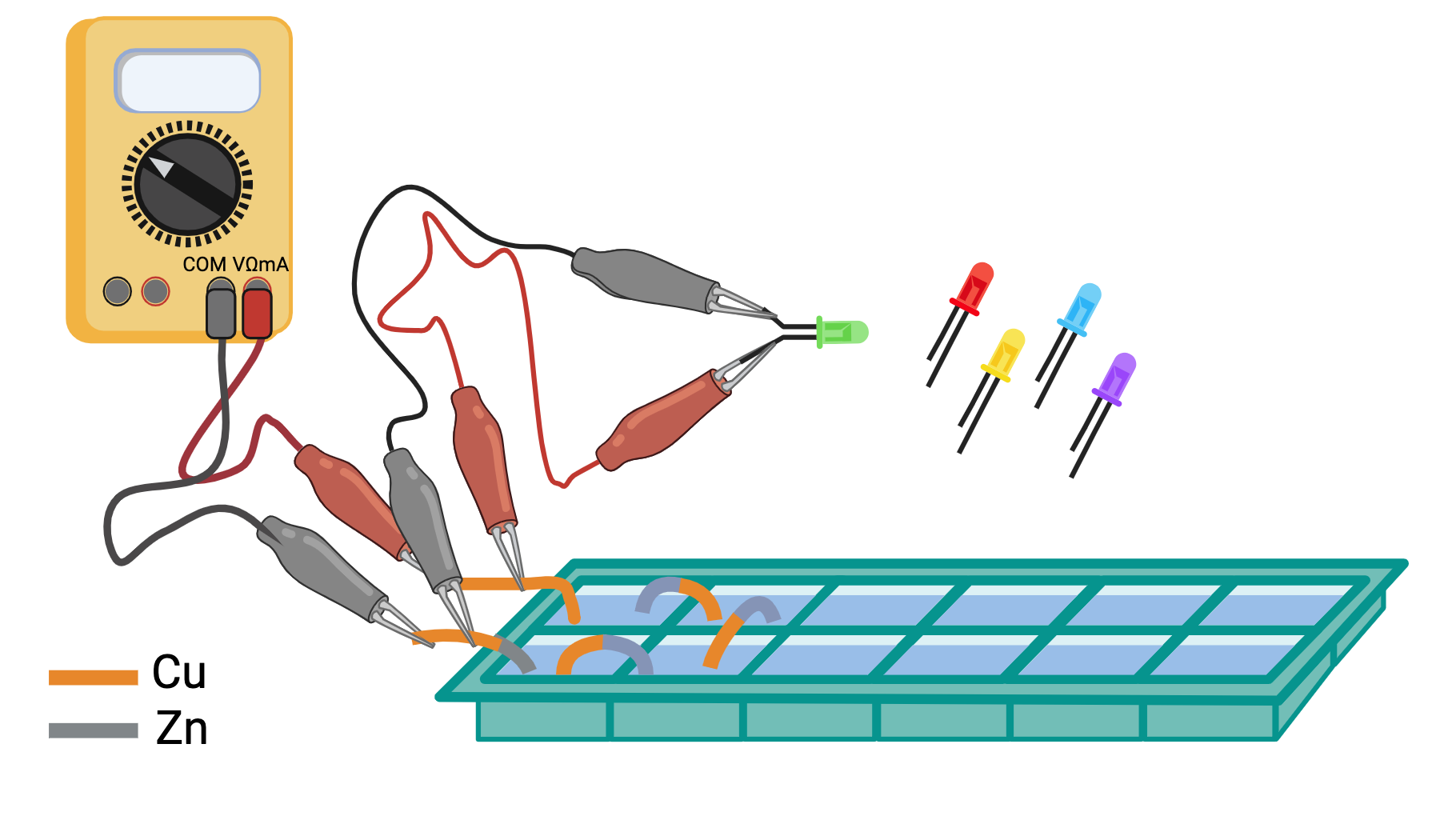
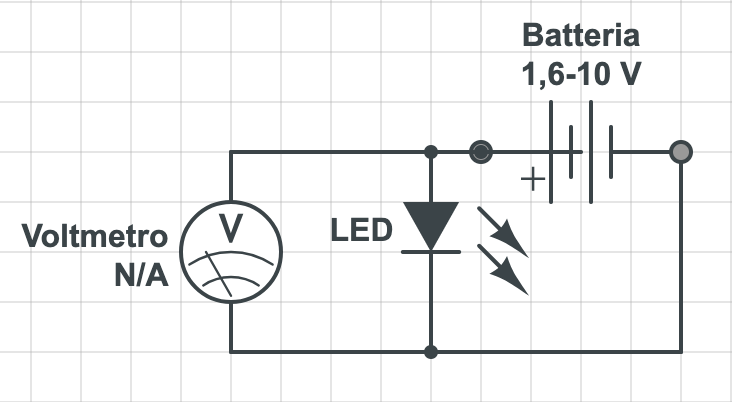
esperienza 5: trasformazione dell’energia elettrica prodotta dalla batteria in luce utilizzando LED e misura della tensione soglia per l’accensione di LED di vari colori usando la differenza di potenziale variabile prodotta dalla batteria al variare del numero di pile in serie.
esperienza 6: una pila fatta da una coppia metallica redox e dai nostri corpi. E magari anche una batteria, fatta da più persone e piastre metalliche messe e in serie o in parallelo.
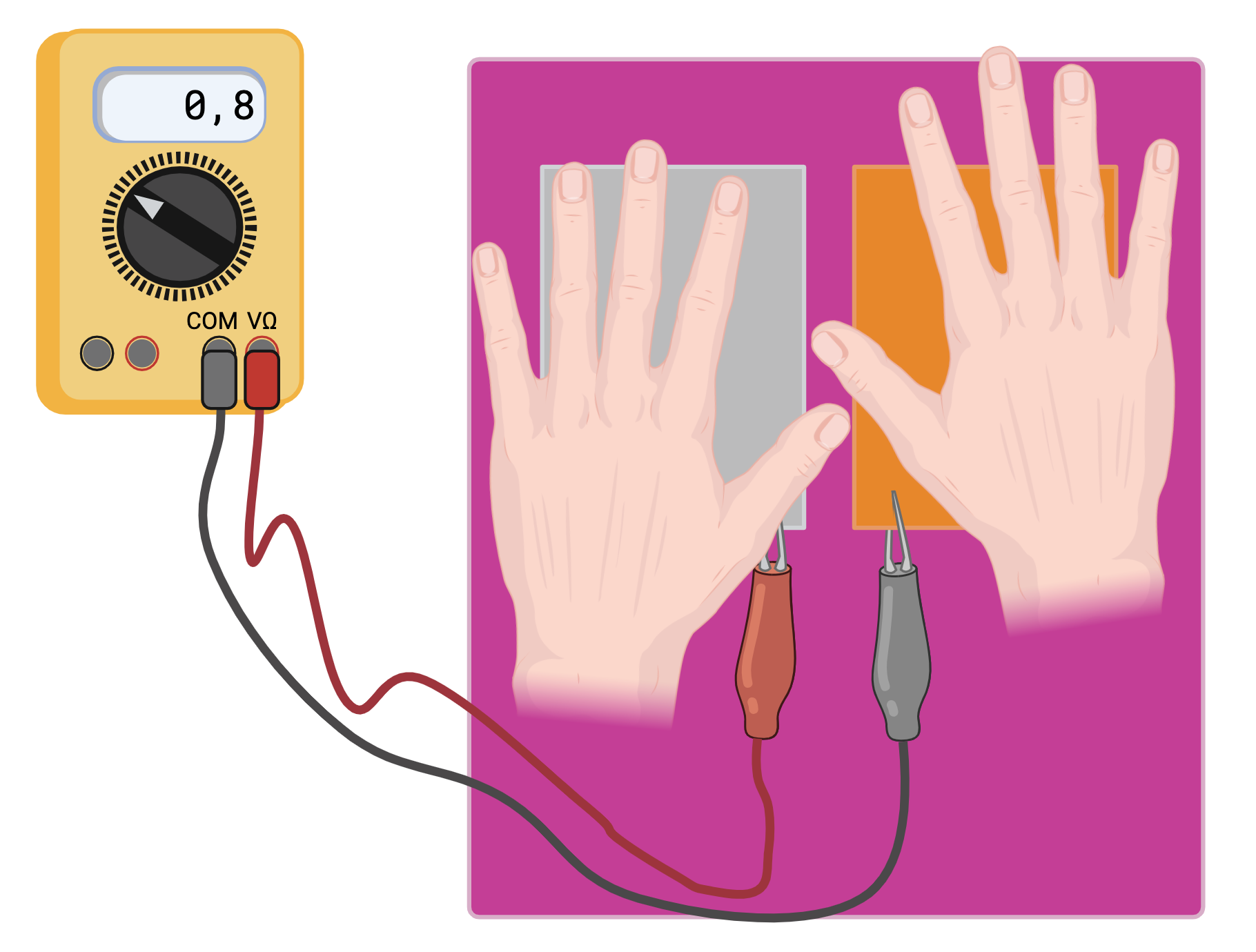
Le piastre metalliche di rame e zinco, sono esposte ad una soluzione elettrolitica quando vengono a contatto con il sudore delle nostre mani. Se chiudiamo il circuito, usando i nostri corpi, il sistema genera un flusso di elettroni direzionato. Più corpi possono essere messi in connessione e anche più piastre, in configurazioni varie in serie e in parallelo. Si registrano variazioni della differenza di potenziale in funzione della tensione generale dalle varie celle e della resistenza che le componenti del sistema oppongono ala passaggio di corrente.
esperienza 7: trasformazioni luce-elettricità, flussi di corrente e conservazione dell’energia redox nei viventi fotosintetici

Misura sperimentale dell’amido presente in foglie illuminate e non illuminate.
L’interazione tra la luce e i fotosistemi innesca un evento fotochimico che alimenta una corrente elettrica attraverso una catena di reazioni redox. L’energia è immagazzinata di molecole ridotte che possono essere usate a brave termine (NADPH e ATP) e conservate per tempi più lunghi (glucosio e polimeri del glucosio).
L’energia immagazzinata è estratta dalle molecole con catene di reazioni redox che danno luogo ad un flusso di elettroni, a una corrente elettrica.
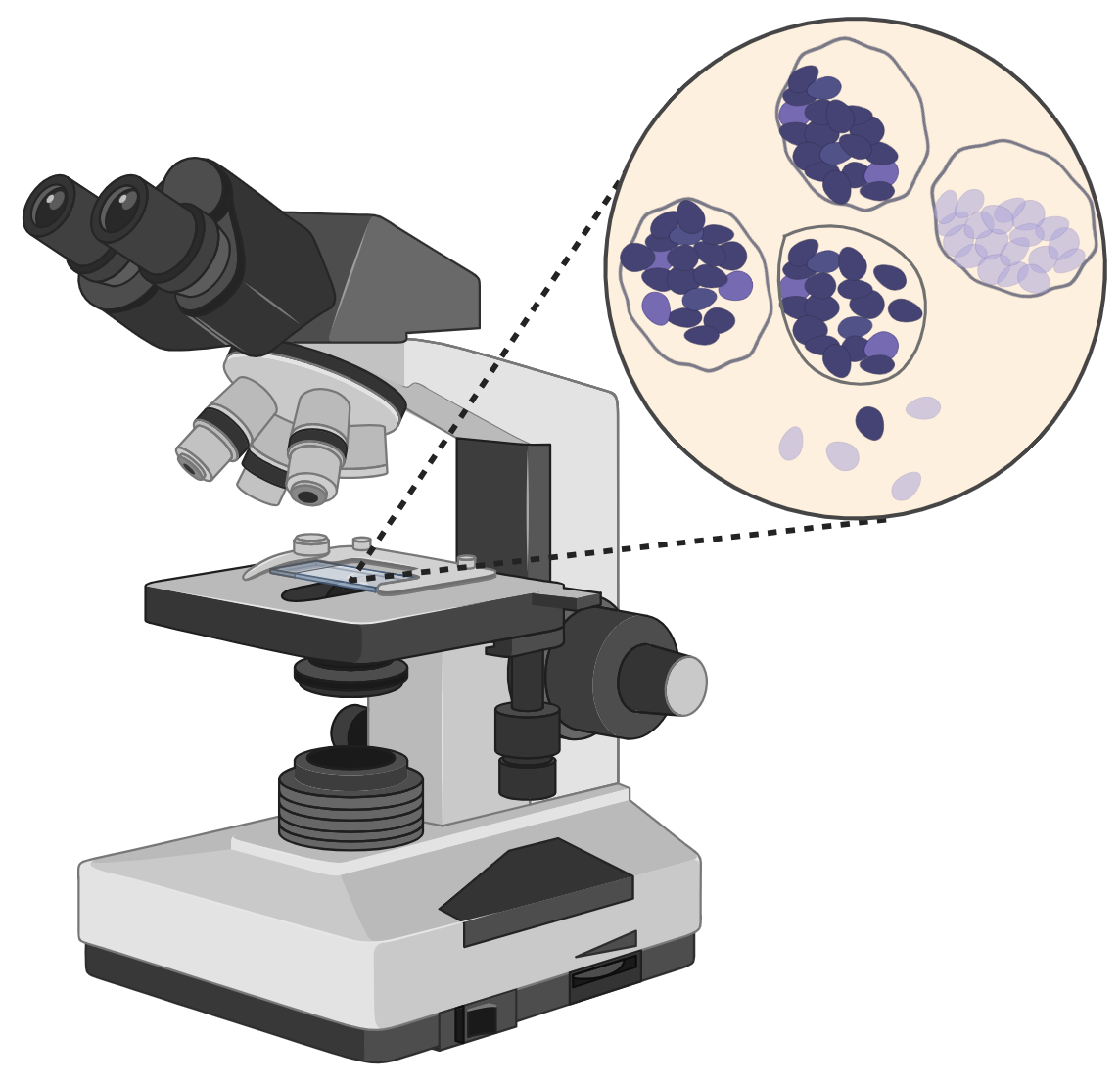
L’energia di riserva conservata nell’amido e accumulata in granuli nei tessuti di alcuni viventi fotosintetici è facilmente visibile al microscopio ottico sia con colorazione al Lugol che senza.
Referenze
Le illustrazioni sono state realizzate con il software online Biorender https://biorender.com
Lo schema del circuiti elettrico è stato realizzato con il software online Circuitlab https://www.circuitlab.com/
La parte di esperienza che riguarda le batterie e le trasformazioni di energia elettrica in luce usando i LED è descritta in dettaglio in un articolo sottomesso per la pubblicazione sulla rivista “La fisica nella scuola” a firma di Elisa Corteggiani Carpinelli, Giacomo Torzo e Egor Skvortsov.
Ringraziamenti
L’esperienza sperimentale esiste grazie all’intelligenza, alla fantasia, alla curiosità, alla voglia di sperimentare e di condividere di Giacomo Torzo, Egor Skvortsov, Adriana Drucinschi, Filippo Fasolo, Alberto Garbinato, Vanessa Gibellato, Maria Sole Lenzi, Lucia Lui, Federico Mozzicato, Andrea Noventa, Camilla Pedrotti, Pier Federico Polignano, Davide Vettore.