I piccoli della nostra specie consumano il latte materno e digeriscono correttamente tutte le sue componenti. Molti individui di varie popolazioni umane sono in grado di digerire il lattosio anche da adulti e possono consumare latte di altri animali quando rappresenta una fonte preziosa di acqua e nutrienti.
E’ interessante misurare la presenza e la concentrazione di lattosio in vari prodotti alimentari di consumo comune e imparare e rilevare la capacità di digerire il lattosio in vari individui di età diversa, con diverso patrimonio genetico ed esperienza di vita.
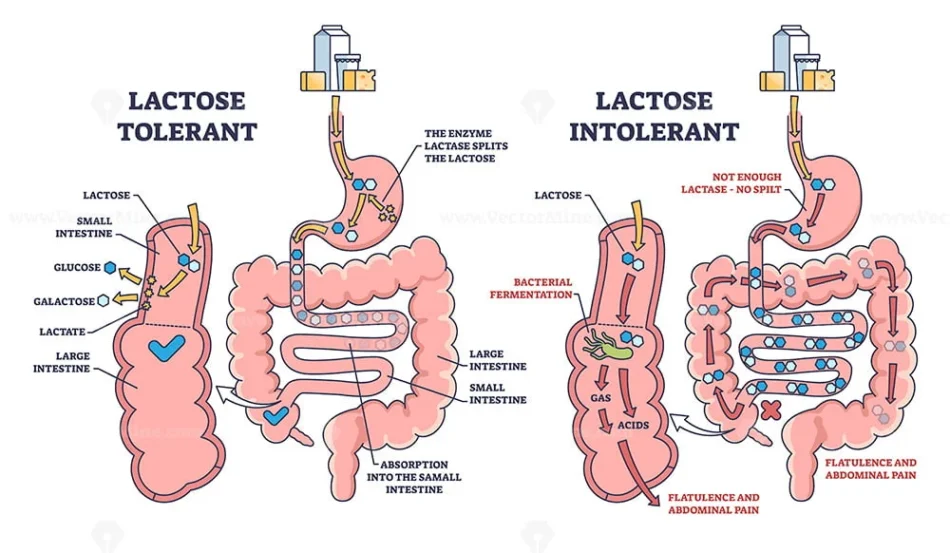
L’idrolisi del disaccaride lattosio, che non viene assorbito nell’intestino umano, nei monosaccaridi glucosio e galattosio, che sono invece normalmente assorbiti nell’intestino umano, viene effettuata dall’enzima lattasi, che è presente in forme omologhe in vari viventi, inclusi l’uomo e vari microbi comunemente presenti nell’intestino di alcune popolazioni umane o utilizzati nella preparazione di prodotti caseari. Le lattasi presenti nell’intestino umano sono codificate da geni presenti in varie forme alleliche nelle popolazioni, vengono espressi in vario modo in vari momenti della vita in base alle informazioni regolatorie presenti nel patrimonio genetico ed epigenetico, e sono espresse da cellule dell’epitelio intestinale, la cui funzionalità può essere fisiologica o alterata da traumi.
La lattasi è un enzima interessante, facilmente reperibile e molto robusto, che può essere un utile modello di studio della funzionalità e della cinetica enzimatica in vari contesti didattici.
Di seguito presento una breve lista di esperienze significative fatte con i miei studenti in questi anni intorno al tema della digestione del lattosio e dello studio delle lattasi, indicando sinteticamente quali sono i principali obiettivi di apprendimento e il livello di preparazione teorica e tecnica richiesto per portare avanti l’esperienza sperimentale e didattica in modo significativo.
Cliccando il + si accede per ciascuna esperienza alle relative schede sperimentali, ad alcune informazioni teoriche utili, a indicazioni per gli insegnanti per allestire gli esperimenti, a indicazioni sui contesti didattici, ai riferimenti ad alcune pubblicazioni utili.
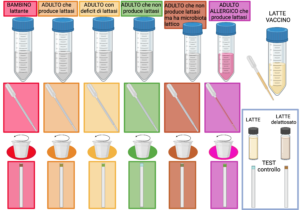
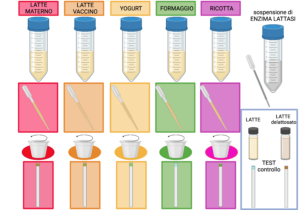
- interessanti per sperimentatori di tutte le età, con competenze iniziali qualsiasi e con l’obbiettivo di esplorare sperimentalmente la presenza di lattosio e la capacità di digerirlo, utilizzando Test Strip commerciali reperibili a costi contenuti:
- una esperienza sperimentale per misurare in modo semi-quantitativo il contenuto di lattosio in diversi prodotti caseari e in diversi sostitutivi dei latticini, che sono pertanto variamente tollerati dalle persone che hanno scarsa o nulla capacità di digerire il lattosio;
- una esperienza sperimentale per far vedere in maniera simulata come la capacità di digerire il lattosio vari in varie persone: i lattanti sono molto capaci; gli adulti che esprimono la lattasi nelle cellule intestinali sono altrettanto efficaci; alcune persone presentano deficienza o totale assenza di lattasi da adulte, per loro caratteristica genetica o per lesioni patologiche del tessuto intestinale; ci sono persone capaci di digerire il lattosio da adulte anche in assenza di lattasi umana, grazie alla presenza di batteri lattici nel tratto intestinale; infine le persone allergiche alle proteine del latte, possono essere in grado di digerire il lattosio, la natura del loro problema è un’altra;
protocolli, teoria e referenze
Le due esperienze molto semplici, accessibili a tutti, interattive e istruttive, sono state progettate e realizzate insieme ad un gruppo di studentesse e studenti del secondo biennio del Liceo Scientifico, che, dopo aver testato e messo a punto gli esperimenti di misura, hanno preparato postazioni semplici da usare, con un codice a colori, volumi facili da prelevare e un protocollo robusto (funziona anche con piccoli errori di esecuzione).
Nelle esercitazioni che proponiamo alle classi, o nelle autogestioni o nelle scuole aperte, spesso in educazione tra pari, le misure di concentrazione del lattosio vengono fatte su prodotti alimentari freschi di vario tipo (dai latticini ai loro più comuni sostituti, come le bevande vegetali). Questo è possibile perché le postazioni vengono preparate e utilizzate nell'arco di uno-due giorni.
Abbiamo portato le due esperienze anche alla mostra interattiva "sperimentando" dove le esperienze sono state utilizzate dal pubblico per circa due mesi. In questo caso gli alimenti freschi sono stati sostituiti da soluzioni acquose contenenti varie concentrazioni di lattosio che consentissero di simulare il contenuto reale di vari alimenti. Le soluzioni contenevano anche tampone fosfato a pH 9 per evitare la crescita dei microrganismo e per consentire in ogni caso un efficace funzionamento dell'enzima lattasi. L'enzima lattasi è molto stabile e può essere conservato in soluzione acquosa satura per lunghi periodi.
Nelle nostre mani questa attività si è rivelata molto riproducibile, molto robusta, molto gradita dal pubblico e molto chiara da comprendere.
Qualche informazione teorica utile scritta dalle studentesse e dagli studenti per descrivere in linea generale il tema della digestione del lattosio nelle popolazioni umane e per raccontare l'allestimento delle esperienze sperimentali.
protocolli sperimentali per utilizzare le postazioni semplificate
qualche schema e foto dell'allestimento e dei test per la messa a punto del metodo
Postazione sperimentale reale, allestita in accordo con gli schemi

- test per la presenza di lattosio in varie tipologie di campioni
- il test di presenza del glucosio è stato effettuato su campioni contenenti lattosio in soluzioni tampone a vari pH ed è risultato in tutti i casi negativo; il test di presenza del glucosio è stato effettuato su campioni contenenti lattosio in soluzioni tampone a vari pH trattati con lattasi e sono state rilevate quantità variabili di glucosio prodotte. Gli estremi a pH basso e pH alto sono le condizioni più efficaci.
- controlli negativi: assenza di glucosio rilevato nel latte; assenza di glucosio rilevato nel latte trattato in assenza di lattasi;controlli positivi: presenza di glucosio in una soluzione di glucosio;test della procedura: presenza di glucosio rilevata in vari campioni di latte trattati con lattasi
Dalla misura del contenuto di lattosio alla misura dell'attività della lattasiLe Test Strip commerciali per il glucosio che usiamo in queste esperienze nella misura semiquantitativa della concentrazione del lattosio di un campione privo di glucosio in seguito a trattamento con lattasi sono state utilizzate anche per studiare la cinetica dell'enzima lattasi con risultati interessanti:
Melton TJ "A Modification of a Lactase Experiment by Use of Commercial Test Strips" (2001) Journal of Chemical Education 78(9) DOI: 10.1021/ed078p1243
In questo caso si lavora
- su soluzioni acquose contenenti lattosio in concentrazioni note e prive di glucosio,
- la digestione del lattosio in presenza di lattasi viene portata avanti in condizioni controllate
- (su campioni con concentrazione iniziale di lattosio nota,
- in condizioni di temperatura controllate
- e per tempi definiti dallo sperimentatore) ,
- la digestione viene interrotta introducendo l'inibitore Na2CO3 a concentrazione utile (ad esempio concentrazione finale in tampone di 0,3 M o anche meno in acqua)
- si effettua la misura della concentrazione di glucosio ottenute dalla digestione sui campioni così ottenuti utilizzando le Test Strip commerciali per il glucosio
Questa procedura consente di studiare in modo indicativi anche se solo semiquantitativo:
- l'effetto della concentrazione iniziale del substrato sulla cinetica enzimatica (a parità di tempo della reazione, si ottiene più glucosio quando l'enzima va più veloce, ovvero quando l'incontro tra l'enzima e il substrato è più probabile e l'enzima non è saturo);
- l'effetto della temperatura (a parità di tempo della reazione e di concentrazione del substrato, si ottiene più glucosio quando l'enzima va più veloce, ovvero quando l'incontro tra l'enzima e il substrato è più probabile e l'enzima non è denaturato).
- interessante per studenti delle secondarie di secondo grado di indirizzo scientifico (licei e tecnici) con conoscenze di partenza di chimica teorica (spettrofotometria, stechiometria, cinetica enzimatica) e abilità tecniche (uso delle micropipette e delle pipette graduate, abitudine alle procedure generali del lavoro di laboratorio di chimica, all’uso delle strumentazioni più comuni e alle norme di sicurezza nella manipolazione delle sostanze chimiche, capacità di portare avanti una titolazione con perizia) con gli obiettivi di quantificare in modo analitico la concentrazione del lattosio in varie tipologie di campioni e di misurare la cinetica enzimatica della lattasi in varie condizioni e su vari substrati. Le esperienze sono riportate per gradi di difficoltà crescenti.
- misura spettrofotometrica del prodotto colorato della digestione di un substrato da parte della lattasi in condizioni controllate e studio della cinetica enzimatica al variare di alcuni parametri significativi (concentrazione del substrato, temperatura, presenza di inibitori competitivi e non competitivi);
protocolli con indicazioni per la preparazione delle postazioni e referenze
La procedura che descrivo qui di seguito è ampiamente utilizzata nelle scuole ed è anche quella che si è rivelata più utile e significativa dal punto di vista didattico nella mia esperienza di insegnante di liceo scientifico. Il successo nella realizzazione degli esperimenti e nella comprensione dei concetti chiave (dipendenza della velocità di reazione dell'enzima dalla concentrazione del substrato, dalla temperatura e dalla presenza di inibitori; importanza dei controlli sperimentali e delle accortezze procedurali per ridurre al minimo le variabili non volute e valutazione critica dei risultati in funziona delle variabili difficili da controllare) è molto elevata per tutti gli studenti e le studentesse delle classi coinvolte. Misuro il successo formativo leggendo e assegnando un punteggio ai fogli risposte del protocollo riportato di seguito e valutando i concetti appresi in queste esercitazione e le abilità e le competenze che ne derivano con verifiche scritte.
La mia esperienza è stata realizzata sulla base della seguente pubblicazione:
L'utilizzo del substrato incolore o-nitrophenyl-β-D-galactopyranoside (ONPG) che viene digerito in un prodotto colorato dalla lattasi, consente di studiare la cinetica dell'enzima lattasi in modo qualitativo o quantitativo con risultati interessanti, ovviamente relativi al substrato utilizzato (il valore assoluto della KM e della Kcat sono diversi da quelli che si ottengono con il substrato naturale lattosio o con altri substrati analoghi):
In questo caso si lavora:
- su soluzioni acquose contenenti lattosio in concentrazioni note e prive di glucosio,
- la digestione del lattosio in presenza di lattasi viene portata avanti in condizioni controllate
- su campioni con concentrazione iniziale di lattosio nota;
- in condizioni di temperatura controllate e che possono essere variate;
- e per tempi definiti dallo sperimentatore;
- in eventuale presenza di inibitori competitivi in diverse concentrazioni
- la digestione viene interrotta introducendo l'inibitore Na2CO3 a concentrazione utile (ad esempio concentrazione finale Na2CO3 0,3 M in tampone o anche meno in acqua)
- si effettua la misura della concentrazione del prodotto di lisi colorato (nel caso di ONPG il reagente è incolore e il prodotto della digestione è di colore giallo) in modo qualitativo (a occhio o con colorimetri più o meno precisi) o quantitativo (con analisi spettrofotometrica)
Questa procedura consente di studiare in modo qualitativo o quantitativo:
- l'effetto della concentrazione iniziale del substrato sulla cinetica enzimatica (a parità di tempo della reazione, si ottiene più prodotto giallo quando l'enzima va più veloce, ovvero quando l'incontro tra l'enzima e il substrato è più probabile e l'enzima non è saturo). Dipendentemente dagli obiettivi di apprendimento stabiliti e dal livello di preparazione degli studenti è possibile ricavare la KM secondo l'equazione di Michaelis Menten;
- l'effetto della temperatura (a parità di tempo della reazione e di concentrazione del substrato, si ottiene più prodotto giallo quando l'enzima va più veloce, ovvero quando l'incontro tra l'enzima e il substrato è più probabile e l'enzima non è denaturato);
- l'effetto di un inibitore competitivo come il lattosio (a parità di tempo e temperature della reazione e di concentrazione del substrato, si ottiene più prodotto giallo quando l'enzima ha un solo substrato, ovvero quando l'incontro tra l'enzima e il substrato ONPG è più probabile).
Lo studio quantitativo richiede l'utilizzo dello spettrofotometro e la conoscenza operativa della relazione di proporzionalità tra il valore misurato e la concentrazione della sostanza che si sta misurando, secondo la legge di Lambert Beer. Questo passaggio per ostico per molti dei mei studenti e delle mie studentesse del liceo scientifico, pertanto è importante scegliere accuratamente la strategia più adatta alle varie classi.
Per quanto riguarda gli aspetti pratici, ho trovato che l'utilizzo di semplici spettrofotometri da banco gestibili attraverso i dispositivi mobili (come quelli commercializzati da Vernier o da Pasco) sia la strategia più indicata e più facile per il lavoro con le classi.
Nella mia esperienza, lo studio della KM è fattibile con gli studenti e le studentesse dei tecnici di vari indirizzi scientifici e con gli studenti del Liceo che seguono percorsi extracurricolari, mentre non è proponibile per le classi.
- misura analitica della concentrazione del lattosio in varie tipologie di campioni (da soluzioni acquose di zuccheri a miscele complesse come latticini e bevande sostitutive) effettuando l’analisi spettrofotometrica del prodotto colorato che si ottiene dalla reazione a stechiometria nota del lattosio con ammoniaca in ambiente basico. La misura analitica si può effettuare anche sui campioni prima e dopo la digestione con lattasi in condizioni controllate e può esser utilizzata per studiare l’attività e la cinetica dell’enzima;
protocolli con indicazioni per la preparazione delle postazioni e referenze
L'esperienza descritta in dettaglio nel protocollo EOES consente di quantificare in modo analitico e specifico il lattosio presente in una soluzione effettuando l'analisi spettrofotometrica del prodotto colorato che si ottiene dalla reazione a stechiometria nota del lattosio con ammoniaca in ambiente basico. L'analisi della concentrazione del lattosio in un campione a titolo ignoto si effettua per confronto con la retta di taratura costruita utilizzando una serie di soluzioni a titolo noto e applicando la legge di Lambert Beer. Questa procedura è nota in letteratura in varie versioni, chiaramente indicate nel protocollo EOES.
Il protocollo contiene anche le istruzioni per ottenere una soluzione chiarificata partendo dal latte.
A differenza della quantificazione indicativa ma imprecisa che si ottiene utilizzando le Test Strip commerciali, questa procedura è interessante e valida dal punto di vista analitico, ma presenta anche maggiori difficoltà sia nell'esecuzione che nella comprensione. Come già detto anche per la procedura con ONPG, la comprensione della spettrofotometria costituisce per molte studentesse e studenti del liceo uno scoglio di difficoltà.
Il protocollo EOES è stato molto interessante per gli studenti e le studentesse che hanno partecipato alla gara ed è stato molto istruttivo per gli studenti che partecipano ad attività extracurricolari di approfondimento, nella mia esperienza si tratta di una procedura troppo lunga e difficile per l'utilizzo curricolare con le classi.
Come nel caso della quantificazione del lattosio con Test Strip commerciali, anche in questo caso e a maggior ragione, è possibile studiare l'attività dell'enzima lattasi, avendo a disposizione un metodo analitico quantitativo per determinare la concentrazione del lattosio prima e dopo la reazione.
Si può utilizzare il protocollo dello studio cinetico della lattasi con il substrato ONPG usando però questa volta il lattosio come substrato e introducendo una reazione prima dell'analisi spettrofotometrica:
In questo caso si lavora:
- su soluzioni acquose contenenti lattosio in concentrazioni note,
- la digestione del lattosio in presenza di lattasi viene portata avanti in condizioni controllate
- su campioni con concentrazione iniziale di lattosio nota;
- in condizioni di temperatura controllate e che possono essere variate;
- e per tempi definiti dallo sperimentatore;
- in eventuale presenza di inibitori competitivi in diverse concentrazioni
- la digestione viene interrotta introducendo l'inibitore Na2CO3 a concentrazione utile (ad esempio concentrazione finale Na2CO3 0,3 M in tampone o anche meno in acqua)
- il prodotto della digestione viene fatto reagire con ammoniaca in ambiente basico come descritto nel protocollo EOES e in particolare
- aggiungi agli 1,5 mL di digestione inibita (1 mL di mix di digestione enzimatica + 0,5 mL di soluzione di inibitore Na2CO3 1 M) un equivolume di tampone glicina/NaOH (1,5 mL)
- aggiungi 0,3 mL gocce di soluzione di metilammina e mescola la soluzione
- metti le provette così ottenute in un contenitore e immergile in un bagno termostatato a 65 °C, per 25 minuti.
- si effettua la misura della concentrazione del prodotto colorato della reazione tra lattosio e metilammina in modo quantitativo con analisi spettrofotometrica, tenendo conto della diluizione del campione iniziale (100 μL di soluzione contenente lattosio in 3,3 mL finali dopo le varie aggiunte, 33 volte più diluito + eventuali ulteriori diluizioni in fase di misura spettrofotometrica)
Questa procedura consente di studiare in modo quantitativo:
- l'effetto della concentrazione iniziale del substrato sulla cinetica enzimatica (a parità di tempo della reazione, si ottiene più prodotto giallo quando l'enzima va più veloce, ovvero quando l'incontro tra l'enzima e il substrato è più probabile e l'enzima non è saturo). Dipendentemente dagli obiettivi di apprendimento stabiliti e dal livello di preparazione degli studenti è possibile ricavare la KM secondo l'equazione di Michaelis Menten;
- l'effetto della temperatura (a parità di tempo della reazione e di concentrazione del substrato, si ottiene più prodotto giallo quando l'enzima va più veloce, ovvero quando l'incontro tra l'enzima e il substrato è più probabile e l'enzima non è denaturato);
La procedura mette in gioco più competenze sia teoriche che pratiche nello stesso tempo:
- lo studio della cinetica enzimatica nei sui aspetti generali e anche quantitativi. Nella mia esperienza di docente del liceo scientifico, lo studio della KM è troppo avanzato per le conoscenze, le competenze e gli obbiettivi tipici di questa scuola;
- l'utilizzo dello spettrofotometro e la conoscenza operativa della relazione di proporzionalità tra il valore misurato e la concentrazione della sostanza che si sta misurando, secondo la relazione legge di Lambert Beer. Questo passaggio per i mei studenti e le mie studentesse del liceo scientifico è sempre ostico in una certa misura e pertanto è importante scegliere accuratamente la strategia più adatta alle nostre classi.
- misura della concentrazione degli zuccheri riducenti in soluzioni acquose semplici con titolazione a caldo con reattivo di Fehling prima e dopo la digestione con lattasi in condizioni controllate per ricavare vari parametri significative della cinetica dell’enzima con il suo substrato fisiologico.
riferimento e link ad un protocollo molto interessante
In quest'ultima sezione riporto il protocollo messo a punto e pubblicato dal bravissimo Renato Bonomi insieme ai suoi studenti dell'ITI Rossi di Vicenza, nell'ambito di un'attività extracurricolare:
Leonello R., Savio M., Baron Toaldo P., Bonomi R. "New Procedure To Readily Investigate Lactase Enzymatic Activity Using Fehling’s Reagent" J. Chem. Educ. 2018, 95, 7, 1238–1242 https://doi.org/10.1021/acs.jchemed.7b00637In questa esperienza il lattosio presente in una soluzione pura, ovvero priva di altri zuccheri riducenti, viene quantificato analiticamente con il metodo di Fehling: i gruppi riducenti presenti in soluzione vengono titolati con una soluzione basica del complesso Cu(II)−tartrato a caldo.In una soluzione di lattosio puro è presente una sola estremità riducente per ogni molecola, in seguito a digestione del lattosio in glucosio e galattosio, le estremità riducenti raddoppiano. La misura analitica della concentrazione delle estremità riducenti prima e dopo di una reazione di digestione in presenza dell'enzima lattasi condotta in condizioni controllate (concentrazione del substrato, temperatura e durata della reazione) consente di misurare la quantità di prodotto e ricavare i parametri cinetici dell'enzima in funzione delle variabili.Per svolgere questa attività è necessario che le studentesse e gli studenti abbiano una buona padronanza delle tecniche di titolazione e una conoscenza approfondita della cinetica enzimatica e dell'equazione di Michaelis Menten. Questa precondizione è presente in alcuni studenti e studentesse dei tecnici di indirizzo scientifico e in alcuni studenti e studentesse del liceo scientifico che frequentano attività extracurricolari di approfondimento della chimica e/o della biochimica. Ho sperimentato l'attività proprio con un piccolo gruppo di studentesse e studenti che fanno da tutor agli allievi più giovani che si preparano per le olimpiadi europee delle scienze sperimentali (EOES). L'esperienza è risultata complessa ma molto stimolante e pertanto mi fa piacere diffonderne la conoscenza e tenerne traccia per utilizzi didattici futuri. Nella mia esperienza questa attività ha una difficoltà troppo elevata sia dal punto di vista tecnico che da quello culturale per le classi del liceo scientifico e ha obbiettivi di apprendimento non allineati con quelli di questo indirizzo di scuola.Gli autori mettono in evidenza alcune considerazioni a mio avviso interessanti, almeno in determinati contesti:- l'analisi quantitativa della concentrazione di lattosio che si può effettuare con il metodo spettrofotometrico descritto anche in questo articolo al punto 2.2, può risultare concettualmente difficoltosa per le studentesse e gli studenti che non padroneggiano ancora la legge di Lambert Beer. Questa procedura, usando la titolazione, può essere una alternativa per superare questa difficoltà e mantiene un livello di precisione elevato (se comparato ad esempio con l'uso delle Test Strip commerciali) - C'è da tenere conto però che l'abilità nelle titolazioni può rappresentare anch'essa uno scoglio. Va valutato in base al percorso degli studenti e delle studentesse ai quali proponiamo l'attività sperimentale;
- L'uso di substrati biomimetici non garantisce che il meccanismo di reazione sia il medesimo che con il substrato naturale e pertanto lo studio dei parametri cinetici dell'enzima potrebbe dare risultati diversi dai parametri fisiologici dell'enzima. - Questa considerazione può essere interessante solo se si approfondisce lo studio dei parametri cinetici e del loro significato, obiettivo tutt'altro che scontato con gli studenti delle scuole secondarie, almeno nei licei e in molti indirizzi dei tecnici e dei professionali.
Provate con le vostre classi o con i vostri studenti e studentesse e fatemi sapere !
- misura spettrofotometrica del prodotto colorato della digestione di un substrato da parte della lattasi in condizioni controllate e studio della cinetica enzimatica al variare di alcuni parametri significativi (concentrazione del substrato, temperatura, presenza di inibitori competitivi e non competitivi);