Questo percorso didattico si compone di una serie di esperienze nelle quali conoscenze e competenze di chimica di diverso livello vengono utilizzate per studiare fenomeni naturali interessanti e rilevanti per l’educazione alla cittadinanza. Nelle varie esperienze le reazioni chimiche, l’acidità, il pH e gli equilibri chimici vengono messi al servizio dello studio della ripartizione dell’anidride carbonica tra atmosfera e oceani in diverse condizioni, dei meccanismi di feedback climatico che coinvolgono gas serra e oceani, degli effetti dell’aumento della disponibilità di anidride carbonica sulla chimica degli oceani e sui viventi che li abitano. Le esperienze che presentiamo sono molto intuitive, possono essere usate in contesti didattici diversi e consentono di lavorare anche sul concetto di modello sperimentale.
Parole chiave: clima, oceani, pH, equilibrio chimico, reazioni chimiche, fotosintesi, modello
Un percorso a tappe, ma anche quattro esperimenti indipendenti
Gli esperimenti proposti formano un percorso didattico su: distribuzione della CO2 tra oceani e atmosfera al variare della temperatura e meccanismi di feedback climatico che ne conseguono; acidificazione degli oceani causata dall’aumento della pressione parziale di CO2; effetti sui viventi con esoscheletro e sui produttori primari all’aumentare della CO2 disciolta e all’abbassamento del pH negli ambienti oceanici.
Ciascuno di questi esperimenti è autoconclusivo, si può scegliere di proporre agli studenti l’intero percorso o solo una o più esperienze.
Prerequisiti e impostazione didattica
Percorso didattico: i tre esperimenti possono essere proposti a studenti con un diverso livello di competenze di base in chimica, adattando gli obiettivi e le richieste di rielaborazione dei risultati ottenuti. Le competenze di chimica acquisite durante il percorso scolastico saranno messe al servizio dello studio di fenomeni complessi relativi alla chimica degli oceani e ai feedback climatici.
Impostazione didattica: gli studenti dovrebbero fare esperienza diretta dei fenomeni utilizzando i modelli sperimentali di laboratorio, analizzando poi in classe i risultati qualitativi e quantitativi ottenuti. La discussione finale allarga la prospettiva verso i modelli interpretativi relativi al clima e agli oceani.
Metodologia: ogni esperienza è composta di a) descrizione; b) procedura sperimentale; c) materiale didattico utile per discutere i modelli interpretativi dei fenomeni sul nostro Pianeta; d) guida per aiutare l’insegnante ad allestire con successo gli esperimenti e a risolvere i problemi più comuni.
Effetto dei gas atmosferici sul pH degli oceani
L’esperimento genera, attraverso reazioni chimiche, i principali gas presenti in atmosfera: ossigeno, azoto, anidride carbonica e idrogeno. Un gassificatore artigianale permette di far gorgogliare i gas in una soluzione di acqua oceanica per verificare, tramite un indicatore universale di pH, il possibile effetto di acidificazione dovuto a ciascun gas, sapendo che c’è un equilibrio fra i gas presenti in atmosfera e quelli disciolti negli oceani.
Figura 1.1 Schema del gassificatore e del sistema sperimentale
L’atmosfera terrestre è composta da azoto per il 78% circa, ossigeno per il 21% circa e il resto è composto da gas presenti in tracce, tra cui anidride carbonica e idrogeno. Le reazioni descritte di seguito consentono di preparare in provetta ciascuno di questi 4 gas e di farli gorgogliare in una soluzione di acqua oceanica e indicatore di pH.
- 2H2O2(aq) → O2(g) + 2H2O(l) in presenza di KI
- NaNO2(aq) + HSO3NH2(s) → N2(g) + NaHSO4(aq) + H2O(l)
- NaHCO3(s) + HCl(aq) → NaCl(aq) + H2O(l) + CO2(g)
- Mg(s) + 2HCl(aq) → H2(g) + MgCl2(aq)
Tabella 1.1 – Reagenti
| Reagente solido (tubo di reazione) | Reagente liquido (siringa) | Gas prodotto |
| 1.0 g KI | 5 ml di soluzione H2O2 10% | ossigeno |
| 1 g HSO3NH2 | 5 ml NaNO2 0,1 M | azoto |
| 5 g NaHCO3 | 5 ml di soluzione HCl 2M | anidride carbonica |
| 2 cm Mg nastro | 5 ml di soluzione HCl 2M | idrogeno |
Tabella 1.2 – Risorse
| Attrezzatura | spatole per prelevare i reagenti in polvere vetreria utile a misurare i volumi delle sostanze liquide vetreria, tappi in gomma e tubi per costruire i piccoli gassificatori come indicato nelle istruzioni della prossima sezione 4 siringhe da 20 mL o più (1 per ogni reagente liquido) |
| Materiali consumabili | indicatore di pH utile nell’intervallo da acido a neutro (ad es. indicatore universale, blu di bromo timolo, rosso cresolo) acqua deionizzata reagenti solidi: nastro di magnesio; KI; HSO3NH2 ; NaHCO3 reagenti liquidi sotto cappa: H2O2 3% ; NaNO2 0,1 M; HCl 3,5% |
| Attrezzatura utile non necessaria | preparato liofilizzato per produrre acqua oceanica (in alternativa si può usare acqua) bilancia e navicelle per pesare i reagenti in polvere (altrimenti possono essere quantificati in modo approssimativo usando delle spatole come dosatori) un dispositivo per documentare con foto o video |
Procedura sperimentale
- sciogli il preparato liofilizzato per oceano in acqua distillata alla concentrazione di 35 g/L (a seconda delle indicazioni fornite dall’esercitatore pesa i sali oppure quantificali con il misurino fornito)
- contrassegna 4 becher ciascuno con il nome del gas che ci farai gorgogliare dentro (O2; N2; CO2; H2) e contrassegna un quinto becher come controllo.
- in ciascun becher versa 50 mL di acqua di oceano e 2 gocce di indicatore di pH
- annota con un pennarello su ciascun tubo di reazione il nome del reagente solido che conterrà.
- preleva e trasferisci nel tubo di reazione ciascuno dei reagenti solidi seguendo le indicazioni della tabella 1.1 (a seconda delle indicazioni fornite dall’esercitatore pesa i reagenti oppure quantificali con il misurino fornito)
- spostati sotto la cappa chimica per prelevare i reagenti liquidi ed eseguire l’esperimento
- preleva con la siringa il reagente liquido necessario per la prima reazione
- Assembla il gassificatore per la prima reazione, come illustrato in figura 1.1.
- metti l’estremità del tubo dentro al bicchierino contenente acqua oceanica e indicatore e conduci la reazione spingendo lo stantuffo della siringa molto lentamente, in modo tale che il reagente liquido cada goccia a goccia sul reagente solido contenuto nella provetta (se la reazione procede troppo velocemente il gas prodotto non sarà l’unica cosa a risalire attraverso il tubo e a gorgogliare nella soluzione e si produrrà un risultato che non rispecchia esclusivamente il contributo del gas che desideri testare).
- osserva cosa succede nel becher e annota i risultati
- procedi con la reazione successiva
- al termine fai una foto al risultato e stima il pH delle soluzioni contenute in ciascuno dei 5 bicchierini in base al colore dell’indicatore (il controllo, dove non è stato fatto gorgogliare niente + i 4 bicchierini dove sono stati fatti gorgogliare 4 diversi gas).
Figura 1.2 – Procedura ed esito atteso dell’esperimento
Tabella 1.3 – Scheda dell’esperimento
| Tempi di realizzazione | 20-30 minuti per allestire e completare l’esperimento |
| Tipologia di risultati | questo esperimento consente di fare osservazioni qualitative, non si ottengono misure quantitative dei fenomeni osservati |
| Indicazioni di pericolo | KI : frasi H 312 – 317 – 391; consigli P 263 – 304 – 305+351+368 – 342+311 – 405+501 Pittogrammi NaNO2 : frasi H 272 – 301 – 400; consigli P 273 – 309+310 Pittogrammi HSO3NH2 : frasi H 319 – 315 – 412; consigli P 273 – 305+351+338 – 302+352 Pittogrammi HCl : frasi H 280 – 314 – 331; consigli P 261 – 280 – 305+351+338 – 310 – 410+403 Pittogrammi H2O2 : frasi H 271 – 302 – 314 – 332 – 335; consigli P 220 – 261 – 280 – 305+351+338 – 310 Pittogrammi |
| Dispositivi di protezione | camice con elastico ai polsi guanti per la manipolazione dei reagenti i reagenti liquidi devono essere prelevati sotto cappa chimica con l’aspirazione accesa mantenendo il vetro abbassato fino all’altezza del viso l’esperienza deve essere condotta sotto la cappa aspirante accesa con il vetro abbassato fino all’altezza del viso può essere consigliabile l’uso di occhiali protettivo, ma la cappa chimica utilizzata in modo corretto dovrebbe offrire una protezione già adeguata |
| Smaltimento degli scarti | Le soluzioni acquose in cui hanno gorgogliato i gas non sono tossiche né dannose per l’ambiente, pertanto vanno smaltite considerando solo le prescrizioni relative all’indicatore di pH che si è scelto di utilizzare, tenendo conto anche del fatto che l’indicatore è presente in piccole quantità ed è considerevolmente diluito. Per quanto riguarda quello che resta delle reazioni all’interno dei gassificatori, è necessario smaltire come rifiuti chimici liquidi. |
Dal modello di laboratorio allo studio del pianeta
Gli studenti osserveranno che la CO2 fa cambiare il pH della soluzione acquosa, mentre gli altri gas non hanno effetti sul pH.
Gli studenti con una preparazione di base in chimica discuteranno con l’insegnante i seguenti fenomeni:
- la quantità di gas disciolto nel liquido aumenta all’aumentare della pressione parziale di ciascun gas nell’atmosfera sovrastante, fino al limite di solubilità;
- la CO2 disciolta, che a T ambiente è al massimo 1,48 g/L, reagisce con l’acqua secondo la reazione all’equilibrio CO2(aq) + H2O(l) ⇄ H2CO3(aq), che ha una Keq = 1,3 x 10-3 e che ha come prodotto un acido debole
Tutti gli studenti rifletteranno con l’insegnante sul fatto che un aumento della quantità di CO2 nell’atmosfera determina un aumento della quantità di CO2 disciolta nell’acqua oceanica, con conseguente diminuzione del pH dell’acqua. Gli studenti con conoscenze di base di chimica potranno riflettere sul fatto che la costante di solubilità e quella di reazione non cambiano, ma una maggiore disponibilità di reagenti aumenta anche la quantità di prodotti mantenendo costante il rapporto tra reagenti e prodotti.
A questo punto è interessante consultare insieme agli studenti dati affidabili sulla concentrazione media di CO2 misurata nell’atmosfera e negli oceani e sul pH misurato degli oceani in un intervallo di tempo recente. Si tratta anche di un’occasione preziosa per educare alla ricerca di dati affidabili, e per presentare agli studenti risorse informative che potranno essere utili punti di riferimento per la loro formazione permanente.
L’agenzia federale statunitense che si interessa di oceanografia, meteorologia e climatologia mette a disposizione del pubblico le misure effettuate e le analisi dei dati sempre aggiornate.
Figura 1.3 – I dati degli ultimi 60 anni relativi alla concentrazione di CO2 nell’atmosfera, nell’oceano e al pH dell’oceano
Indicazioni per l’insegnante
L’esecuzione di questo esperimento richiede la disponibilità di attrezzatura adatta per la costruzione dei gassificatori. I tubini di volume adatto, con chiusura ermetica e tubatura di ingresso e di uscita possono essere acquistati da Carolina biotech (link in bibliografia). E’ possibile costruire il sistema utilizzando tubi in plastica tipo Falcon chiudendoli in modo ermetico con tappi in gomma nei quali saranno stati praticati due fori, uno per l’ingresso, compatibile con la siringa, e uno per il tubino di uscita del gas. E’ infine possibile utilizzare vetreria da laboratorio con chiusura ermetica in alto e una apertura laterale in alto per il tubino di uscita del gas.
In tutti i casi sarà necessario fare delle prove per adattare le quantità e i volumi dei reagenti e dei gas prodotti ai volumi dei contenitori utilizzati (poco gas prodotto in un contenitore grande non produce abbastanza gas da far gorgogliare all’interno delle soluzioni di acqua oceanica)
E’ molto importante testare la cinetica di reazione e aggiustare le quantità dei reagenti solidi e le concentrazioni dei reagenti acquosi in modo tale che si abbia fuoriuscita del solo gas attraverso il tubino e che non ci sia in mezzo anche schiuma di reazione. Questa accortezza è particolarmente importante per la reazione tra l’amidetriossosolfato di idrogeno e il biossonitrato di sodio, che oltre a produrre N2 produce anche idrogenosolfato di sodio, che è un acido (NaNO2(aq) + HSO3NH2(s) → N2(g) + NaHSO4(aq) + H2O(l)). Se i prodotti acidi o basici della reazione si mescolano con il gas di uscita alterano il risultato sperimentale. Se la reazione è molto veloce, l’esito dell’esperimento varia al variare della velocità con la quale lo sperimentatore opera, è pertanto importante operare in condizioni di cinetica ottimali perché l’esperimento dia risultati visibili, ma anche riproducibili nelle mani dei diversi studenti.
Solubilità della CO2 in acqua al variare della temperatura
In questo esperimento si osserva la CO2 che abbandona la soluzione acquosa all’aumentare della temperatura seguendo le bollicine e il pH della soluzione. L’esperienza serve a riflettere su cosa succede negli oceani quando cambia la temperatura: quando la temperatura media degli oceani è più bassa molta CO2 si scioglie nell’acqua oceanica e rimane sequestrata, mentre l’aumento della temperatura degli oceani provoca un rilascio dei gas nell’atmosfera, compresi quelli climalteranti.
Se si osserva con attenzione il comportamento delle bollicine di gas nei due campioni e la variazione di colore, si può facilmente intuire che la solubilità dei gas nel liquido diminuisce al crescere della temperatura. E’ utile far ragionare gli studenti sulle esperienze di vita quotidiana in cui osservano questo, pensando a cosa succede alle bibite gassate tenute al caldo o al fresco.
E’ inoltre molto interessante proporre l’esperimento a studenti che abbiano già affrontato in chimica le proprietà delle soluzioni, la solubilità, la legge di Henry, gli equilibri e le reazioni acido base (idealmente quindi studenti di 4 liceo scientifico o tecnico), per ragionare con loro in modo più approfondito e anche quantitativo sul fenomeno.
Tabella 2.1 – Risorse
| Attrezzatura necessaria | una piastra riscaldante bicchieri resistenti alle alte temperature (ad es. becher in boro silicato da laboratorio) |
| Materiali consumabili | indicatore di pH utile nell’intervallo da acido a neutro (ad es. indicatore universale, blu di bromo timolo, rosso cresolo) acqua con uguale composizione chimica in forma naturale e addizionata di CO2 |
| Attrezzatura utile non necessaria | un cronometro o orologio un dispositivo per documentare con foto o video |
Tabella 2.2 – Scheda dell’esperimento
| Tempi | 20-30 minuti per completare l’esperimento l’esperimento si allestisce in pochi minuti e poi si osserva e si documenta il risultato |
| Tipologia di risultati | questo esperimento consente di fare osservazioni qualitative, non si ottengono misure quantitative dei fenomeni osservati |
| dispositivi di protezione | manopole per l’isolamento termico per evitare ustioni se si toccano inavvertitamente i becher con le soluzioni calde o la piastra riscaldante calda. |
| smaltimento degli scarti | La soluzione acquosa non è tossica né dannosa per l’ambiente, pertanto va smaltita considerando solo le prescrizioni relative all’indicatore di pH che si è scelto di utilizzare, tenendo conto anche del fatto che l’indicatore è presente in piccole quantità ed è considerevolmente diluito. |
Procedura sperimentale e risultati attesi
- Trasferisci in un becher pulito 25 mL di acqua minerale naturale e aggiungi 2 gocce di indicatore. (Puoi misurare il volume approssimativo usando le tacchette del becher)
- Trasferisci in un secondo becher pulito lo stesso volume di acqua minerale addizionata di CO2 e aggiungi 2 gocce di indicatore
- Osserva e annota il colore delle due soluzioni
- Metti i due campioni sopra ad una piastra riscaldante accesa (la temperatura può essere fissata intorno ai 100°C)
- Osserva l’esperimento fino a quando le due soluzioni non abbiano raggiunto il bollore e abbiano bollito per circa 1 minuto.
- Annota le tue osservazioni ad intervalli di tempo regolari con l’aiuto di un cronometro.
- Puoi filmare l’evento in time lapse con un dispositivo mobile.
Figura 2.1 Procedura ed esito atteso dell’esperimento
Dal modello di laboratorio allo studio del pianeta
Gli studenti con scarse conoscenze di chimica avranno ora chiaro che più si scalda l’acqua oceanica più i gas e l’anidride carbonica in particolare abbandonano la soluzione.
Gli studenti con una preparazione di chimica di base potranno riflettere insieme all’insegnante su questa sequenza di eventi concatenati:
CO2(g) + H2O(l) ⇄ CO2(aq) + H2O(l) la solubilità è 1,688 g/L a 293,15 K e 1.48 g/L a 298,15 K
CO2(aq) + H2O(l) ⇄ H2CO3(aq) Keq = 3,8 ∙10‒3
H2CO3(aq)+ H2O(l) ⇄ HCO3–(aq)+ H3O+(aq) Ka1 = 4,45 ∙10‒7
potranno calcolare il pH dell’acqua pura per una quantità di CO2 gassosa data e risalire alla concentrazione di CO2 disciolta basandosi sul pH.
Con tutti gli studenti è utile a questo punto riflettere sulla distribuzione dei gas in equilibrio fra atmosfera e oceano e sul meccanismo di feedback climatico che si innesca quando cambia la temperatura media degli oceani.
Figura 2.2 Feedback climatici del sistema oceano-atmosfera-CO2
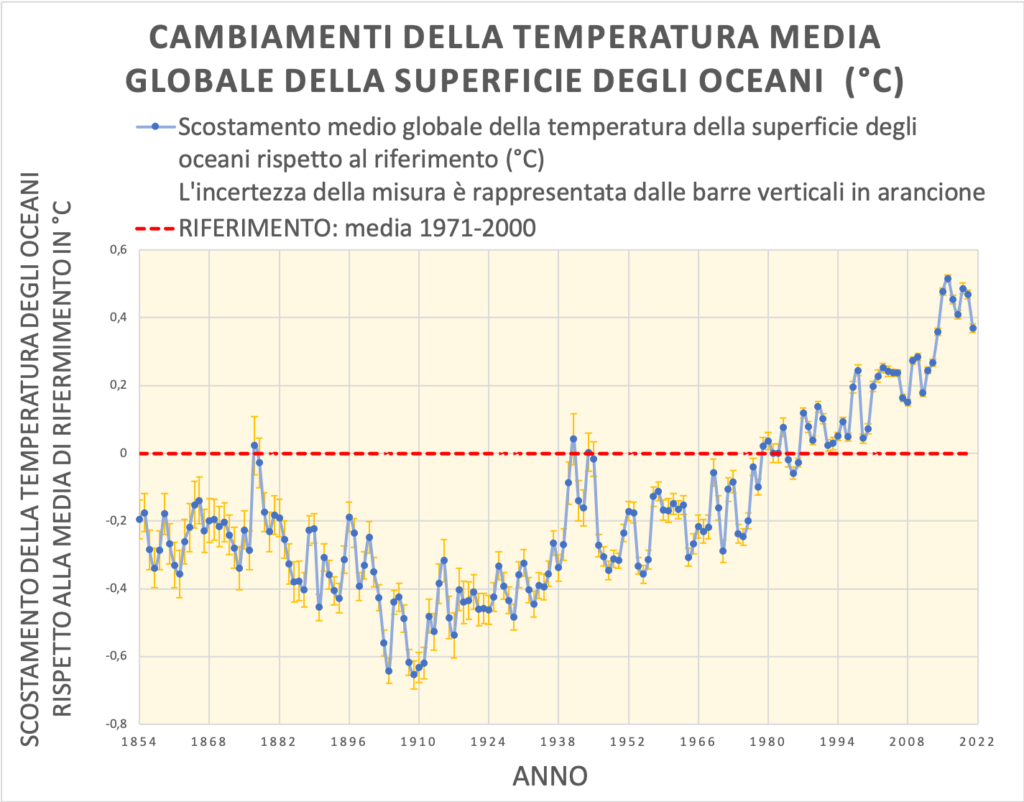
E’ utile poi consultare insieme agli studenti dati affidabili sulla temperatura media misurata degli oceani e sulla sua variazione in un intervallo di tempo recente per riflettere sul quale possa essere oggi il contributo degli oceani al cambiamento climatico. Anche in questo caso l’occasione è preziosa per educare alla ricerca di dati affidabili e alla valutazione critica del valore di una stima in ragione dell’errore di misura.
Figura 2.3 Variazione della temperatura media annua della superficie oceanica
Indicazioni per l’insegnante per allestire con successo l’esperimento
E’ utile accendere la piastra riscaldante con un po’ di anticipo per ridurre i tempi. E’ inoltre utile portare l’attenzione dei ragazzi sul movimento delle bollicine nei campioni di acqua frizzante quando la temperatura della soluzione acquosa è ancora molto inferiore alla temperatura di ebollizione.
Effetto della concentrazione di CO2 e di carbonato sugli esoscheletri
In questo esperimento si osserva l’effetto della concentrazione di CO2 e del pH sulla precipitazione e sulla solubilizzazione del carbonato di calcio in ambiente acquoso. Il modello sperimentale può essere usato per riflettere su vari fenomeni, in questo specifico caso viene utilizzato per ragionare sugli scheletri carbonatici dei viventi che si trovano in ambienti oceanici con caratteristiche più o meno favorevoli al deposito o allo scioglimento.
Tabella 3.1 – Risorse
| Attrezzatura necessaria | una bilancia tecnica precisa contenitori che possano essere chiusi bene (ad es. tubi con tappo a vite o barattoli) strumentazione per misurare volumi in modo preciso (ad es. cilindri graduati) |
| Materiali consumabili | frammenti di rocce carbonatiche o di materiale corallino di dimensioni omogenee acqua con uguale composizione chimica in forma naturale e addizionata di CO2 |
| Attrezzatura utile non necessaria | una stufa per seccare i campioni più velocemente |
Tabella 3.2 – Scheda dell’esperimento
| Tempi | 10 giorni almeno per completare l’esperimento l’esperimento si allestisce in 20 minuti dopo una settimana (o più) si interviene brevemente sull’esperimento rimuovendo la soluzione acquosa e mettendo a seccare i frammenti di roccia dopo 2 o 3 giorni i campioni sono secchi e, dal quel momento in avanti, si può procedere misurano i risultati ottenuto |
| Tipologia di risultati | questo esperimento consente di fare misure quantitative dei fenomeni osservati |
Procedura sperimentale
- prepara 5 soluzioni acquose misurando i volumi con i cilindri graduati:
- no CO2 (acqua naturale) ;
- CO2 bassa concentrazione (10 acqua frizzante – 90% acqua naturale);
- CO2 media concentrazione (50 acqua frizzante – 50% acqua naturale);
- CO2 alta concentrazione (25 acqua frizzante – 75% acqua naturale);
- eccesso di CO2 (acqua frizzante)
- prendi 5 contenitori di capienza ~50 mL, di forma qualsiasi e con tappo ermetico e col pennarello annota l’esperimento che ciascuno conterrà: no CO2 ; CO2 bassa concentrazione ; CO2 media concentrazione; CO2 alta concentrazione; eccesso di CO2
- distribuisci in ciascun contenitore una medesima quantità di frammenti di sabbia corallina di analoghe dimensioni (indicativamente 10-20 frammenti)
- pesa il contenuto di ciascuno e annota il peso che hai ottenuto
- metti all’interno di ciascun contenitore i frammenti pesati e 50 mL della corrispondente soluzione acquosa
- chiudi bene i contenitori con il tappo e lasciali incubare per 1-2 settimane
- dopo 2 settimane (o una) prendi i contenitori, elimina la soluzione acquosa facendo attenzione a non buttare via anche i frammenti di sabbia corallina. Risciacqua più volte i frammenti di sabbia corallina con acqua deionizzata. Elimina l’acqua per sversamento e quindi mettili ad asciugare (all’ario o in stufa) per eliminare l’acqua residua.
- quando i frammenti saranno secchi pesali e annota il risultato ottenuto in una tabella
- confronta il peso iniziale e il peso finale dei campioni di sabbia corallina in ciascun esperimento
- costruisci un grafico delle differenze di peso (finale – iniziale) in relazione alla concentrazione di CO2
Figura 3.1 Procedura dell’esperimento
Dal modello di laboratorio allo studio del pianeta
Se l’esperimento riesce, gli studenti scoprono che gli ambienti acidi e ricchi di CO2 favoriscono la solubilizzazione del carbonato di calcio e ne impediscono la precipitazione.
Gli studenti con una preparazione di chimica di base potranno riflettere insieme all’insegnante su questa sequenza di eventi concatenati:
CO2(g) + H2O(l) ⇄ CO2(aq) + H2O(l) la solubilità è 1,688 g/L a 293,15 K e 1.48 g/L a 298,15 K
CO2(aq) + H2O(l) ⇄ H2CO3(aq) Keq = 3,8 ∙10‒3
H2CO3(aq)+ H2O(l) ⇄ HCO3–(aq)+ H3O+(aq) Ka1 = 4,45 ∙10‒7
CaCO3(s) + H2CO3(aq) ⇄ Ca(HCO3)2(aq)
e ragionare sulle condizioni che possono favorire la sintesi di CaCO3(s) o la sua solubilizzazione a Ca(HCO3)2(aq) in base agli equilibri di reazione coinvolti e ai parametri che possono alterare le varie costanti di equilibrio.
Con tutti gli studenti è utile consultare misure affidabili del pH degli oceani e fonti divulgative affidabili che raccontino gli studi più recenti sull’effetto dell’acidificazione dell’oceano su vari viventi con esoscheletro e in particolare sulle barriere coralline.
Indicazioni per l’insegnante per allestire con successo l’esperimento
L’esperimento è riproducibile, ma la differenza di massa che si misura è molto piccola e la differenza è chiara solo per campioni tenuti in acqua frizzante per almeno una settimana. Per accertare se le differenze misurate siano dovute alle variabili sperimentali o a errori casuali è importante che gli studenti confrontino tra loro i risultati ottenuti dai vari gruppi e calcolino e valori medi e gli errori casuali.
Se tutti i campioni risultano avere massa maggiore alla fine dell’esperimento, l’errore sistematico è dovuto ad una essiccazione non completa dei campioni. Il passaggio di essiccazione è importante per l’esito dell’esperimento.
Efficienza fotosintetica al variare della concentrazione di CO2 e del pH
In questo esperimento si osserva l’effetto della concentrazione di CO2 e del pH sull’efficienza fotosintetica di una pianta acquatica e l’idea è quella di indagare gli effetti dell’acidificazione degli oceani sulla produzione primaria e sulla sopravvivenza e abbondanza delle alghe verdi e delle piante negli oceani.
Tabella 4.1 – Risorse
| Attrezzatura necessaria | un lampada con intensità luminosa pari almeno a quella di una lampadina da 60 watt contenitori trasparenti stretti e lunghi (poco volume alta superficie illuminata) che possano essere chiusi strumentazione per misurare volumi in modo preciso (ad es. cilindri graduati) bilancia tecnica precisa |
| Materiali consumabili | indicatore universale di pH(o in alternativa cartine per la misura del pH utili in un ampio intervallo di pH (4-11) acqua con uguale composizione chimica in forma naturale e addizionata di CO2 |
| Attrezzatura utile non necessaria | un dispositivo per documentare con foto o video un dispositivo per misurare l’intensità luminosa in un punto dello spazio un pHmetro |
Tabella 4.2 – Scheda dell’esperimento
| Tempi | 2 giorni per completare l’esperimento l’esperimento si allestisce in 30 minuti circa e poi si osserva e si documenta il risultato dopo due giorni di illuminazione |
| Tipologia di risultati | questo esperimento consente di fare sia osservazioni qualitative, che misure quantitative dei fenomeni osservati |
| smaltimento degli scarti | La soluzione acquosa non è tossica né dannosa per l’ambiente, pertanto va smaltita considerando solo le prescrizioni relative all’indicatore di pH che si è scelto di utilizzare, tenendo conto anche del fatto che l’indicatore è presente in piccole quantità ed è considerevolmente diluito. Le piante acquatiche saranno ancora vitali dopo l’esperimento e possono essere conservate e riutilizzate in laboratorio, se devono essere smaltite, è necessario fare attenzione alle specie infestanti e aliene prima di disperderle nell’ambiente. |
Procedura sperimentale e risultati attesi
- prepara 5 soluzioni acquose misurando i volumi con i cilindri graduati:
- no CO2 (acqua naturale) ;
- CO2 bassa concentrazione (10 acqua frizzante – 90% acqua naturale);
- CO2 media concentrazione (50 acqua frizzante – 50% acqua naturale);
- CO2 alta concentrazione (25 acqua frizzante – 75% acqua naturale);
- eccesso di CO2 (acqua frizzante)
- prendi 5 tubi di vetro trasparente con tappo ermetico e col pennarello annota l’esperimento che ciascuna conterrà: no CO2; CO2 bassa concentrazione; CO2 media concentrazione; CO2 alta concentrazione; eccesso di CO2
- distribuisci in ciascun tubo una medesima quantità di una stessa pianta acquatica a tua disposizione (ad esempio elodea o lenticchia d’acqua) – per mettere la stessa quantità di tessuto fotosintetico in ciascun tubo scegli tessuti verdi e metti una stessa massa di tessuto verde pesando con la bilancia a disposizione
- aggiungi a ciascun tubo la corrispondente soluzione acquosa in quantità tale da riempirlo
- prepara 5 tubi di controllo che contengano ognuno una delle soluzioni acquose ma niente piante
- chiudi bene i tubi con il tappo
- metti tutti i tubi difronte alla sorgente luminosa (una lampada accesa in modo continuativo 24h/24h) in modo tale che ricevano tutte la stessa quantità di luce (puoi misurare l’intensità luminosa col sensore del tuo cellulare all’interno della app “Science Journal” di Google e registrare la misura)
- aspetta 2 giorni
- se hai a disposizione un pHmetro, misura con il pHmetro il pH dell’acqua di controllo e quello dell’acqua contenente anche le piante per ciascun esperimento
- annota le misure che hai ottenuto e mettile in tabella insieme alla differenza di pH tra l’esperimento con la pianta e quello di controllo (stessa acqua ma senza pianta). La differenza costituisce una stima dell’attività fotosintetica)
- costruisci un grafico delle differenze di pH (con pianta – senza pianta) in relazione alla concentrazione di CO2
- metti una goccia di indicatore in ciascuno degli 8 tubi e fotografa il risultato. Se non hai a disposizone un pHmetro, utilizza la scala di colori dell’indicatore universale per stimare il pH di ciascun campione e valuta l’efficienza fotosintetica basandoti sulla differenza di pH tra l’esperimento con la pianta e quello di controllo (stessa acqua ma senza pianta)
Figura 4.1 Procedura ed esito atteso dell’esperimento
Dal modello di laboratorio allo studio del pianeta
Osservando i risultati sperimentali, gli studenti avranno chiaro che il pH della soluzione si alza solo in presenza di piante e luce e che l’innalzamento del pH è maggiore nei campioni con pH di partenza vicino a 7 e con concentrazioni di CO2 basse. Sarà quindi evidente che l’attività fotosintetica è maggiore in ambienti neutri e che l’aumento della concentrazione di CO2 non favorisce il processo.
Gli studenti con conoscenze di base del metabolismo fotosintetico e del pH (e quindi gli studenti di 3-4-5 liceo scientifico o tecnico) potranno ragionare insieme all’insegnante sul fatto che la fotosintesi assorbe la CO2 dal sistema e la riduce in carboidrati. Sequestrando la CO2 la fotosintesi fa innalzare il pH. Intuitivamente maggiore è la disponibilità di CO2 e più efficiente dovrebbe essere la fotosintesi, sorprendentemente però, nella nostra esperienza, non sembra essere così e ad alte concentrazioni di CO2, quando il pH si abbassa, la fotosintesi si arresta. E’ possibile progettare con gli studenti esperimenti di controllo in presenza di basse concentrazioni di CO2 e in totale assenza del gas, oppure in presenza di quantità crescenti di CO2 mettendo però anche un tampone di pH nella soluzione. Si scoprirà così che non c’è fotosintesi in assenza di CO2 e che non è la concentrazione di CO2, bensì l’abbassamento del pH a inibire il processo fotosintetico. L’esperimento descritto e gli esperimenti di controllo proposti funzionano bene in classe sia con le piante che con le alghe unicellulari, ma richiedono un lavoro di messa appunto da parte dell’insegnante.
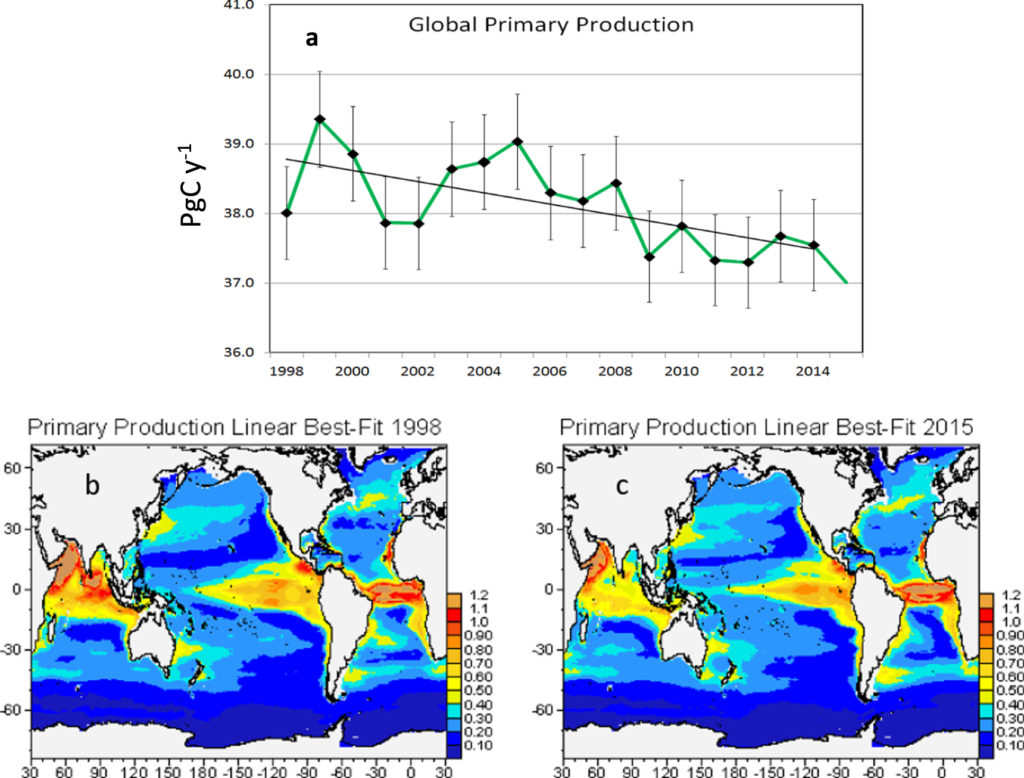
Con tutti gli studenti è possibile consultare i dati su l’acidità degli oceani misurata negli ultimo 20-30 anni, facendo attenzione alla fonte e all’intervallo di confidenza delle misure e consultare poi studi affidabili sulla produzione primaria degli oceani stimata misurando la fluorescenza media della clorofilla con l’utilizzo di satelliti che misurano per 24 ore al giorno
Figura 4.2 Dati sulla produzione primaria media degli oceani dal 1998 al 2015
Indicazioni per l’insegnante per allestire con successo l’esperimento
Perché l’attività fotosintetica sia misurabile è importante fare attenzione a due parametri: l’intensità e il colore della sorgente luminosa, che deve essere corrispondente a 60 watt o più, non più distante di 5-10 cm dai campioni e deve essere bianca (oppure rossa o blu); il secondo parametro è lo stato di salute della pianta acquatica, l’esperimento funziona bene con varie piante acquatiche, ma l’efficienza è maggiore se il tessuto fotosintetico è verde e in salute.
La procedura sperimentale indica di illuminare i campioni in modo continuo, una eventuale alternanza di luce e buio implicherebbe un abbassamento di pH nelle ore al buio rendendo più difficile la lettura e l’interpretazione del risultato comparativo dei vari campioni.
E’ possibile proseguire l’esperienza anche dopo aver messo l’indicatore di pH nei tubini, perché l’effetto di filtrazione della luce dei coloranti è trascurabile.
Le esperienze didattiche che hanno dato vita a questa serie di esperimenti
L’esperienza didattica che viene presentata in questo articolo è stata sviluppata per la prima volta nel 2017 come prova interdisciplinare per gli studenti che partecipavano alle olimpiadi delle scienze applicate, che nel 2017 si chiamavano EUSO e ora si chiamano EOES.
Negli anni a seguire gli studenti di una quarta liceo scientifico indirizzo scienze applicate del Liceo Fermi hanno costruito gli apparati sperimentali, svolto gli esperimenti e analizzato i risultati all’interno di un progetto di PCTO di classe. Gli esperimenti erano inseriti in un progetto più ampio sulla conoscenza e la salvaguardia delle coste e dei mari che si chiama “Guardiani della Costa”, che è promosso da Costa Crociere, ARPAL e scuola italiana di Robotica e che nel nostro Liceo ha coinvolto anche i ricercatori della stazione idrobiologica di Chioggia.
Gli studenti delle classi quarte del nostro liceo oggi fanno spesso queste esperienze utilizzando apparati e protocolli già messi a punto dai loro compagni e utilizzando le proprie conoscenze di chimica per elaborare i dati.
Nella nostra scuola è attivo dal 2019 un gruppo di studenti e docenti di scienze interessati a studiare sostenibilità e clima e a contribuire ad un futuro sostenibile per il nostro Pianeta, il “Fermi for future”. Nell’ambito di questo progetto, abbiamo proposto agli studenti le 4 esperienze sperimentali descritte in questo articolo nella versione senza l’analisi degli equilibri chimici e senza i calcoli del pH, hanno partecipato studenti di varie classi, con varia preparazione di chimica di base e gli studenti più esperti hanno fatto da educatori ai più giovani.
In seguito a questa esperienza un gruppo di studenti del “Fermi for future” si è proposto di mettere a punto una versione divulgativa e di facile allestimento di queste 4 esperienze da portare alla mostra “sperimentando” perché fosse proposta ad un pubblico senza preparazione di base in chimica, che potesse fare esperienza diretta di fenomeni importanti per il clima grazie a sistemi esperienziali estremamente intuitivi. Gli studenti hanno lavorato durante la pandemia e hanno messo appunto con successo quattro postazioni sperimentali per la mostra, premiate con il secondo posto al concorso “Sperimenta anche tu 2021”.
Oggi queste esperienze, insieme ad altre ideate e realizzate dagli studenti di “Fermi for future” e “Sperimenta anche tu”, sono protagoniste di una giornata aperta, nella quale il nostro liceo si apre alla cittadinanza e gli studenti guidano i passanti che decidono di entrare alla scoperta di concetti importanti attraverso la sperimentazione.
Bibliografia e sitografia
L’esperienza è stata elaborata sulla base della proposta di Carolina biological supply, venduta come kit e descritta al seguente link: https://www.carolina.com/ap-environmental-science-lab-kits/carolina-investigations-for-ap-environmental-science-ocean-acidification-kit-8-station-with-prepaid-coupon/181069.pr
Le immagini presenti in questo articolo sono state create usando BioRender.com (https://app.biorender.com/)
I dati riguardanti la concentrazione di CO2 e il pH degli oceani sono prodotti e resi pubblici dal NOAA PMEL Carbon Program https://www.pmel.noaa.gov/co2/story/Ocean+Acidification
La figura che riporta il grafico della variazione di temperatura media della superficie degli oceani è stata prodotta dagli autori utilizzando i dati pubblicati in da Huang, B. et al nel 2017 “Extended Reconstructed Sea Surface Temperature version 5 (ERSSTv5), Upgrades, validations, and intercomparisons.” J. Climate, 30, 8179-8205, doi:10.1175/JCLI-D-16-0836.1. I dati utilizzati per la stima degli errori riportata nel grafico sono stati pubblicati in Huang, B.et al 2020 “Uncertainty estimates for sea surface temperature and land surface air temperature in NOAAGlobalTemp version 5.” J. Climate, 33, 1351-1379, DOI: 10.1175/JCLI-D-19-0395.1.
I dati e la figura sulla produzione primaria negli oceani utilizzati in questo articolo vengono dalla seguente pubblicazione: Gregg, W W and Rousseaux, C S (2019). Global ocean primary production trends in the modern ocean color satellite record (1998–2015). Environmental Research Letters, Volume 14, Number 12
EOES – European Olympiad of Experimental Science https://www.eoes.science/
“Guardiani della Costa” https://guardianidellacosta.it/
L’articolo che avete appena letto è stato anche accettato per la pubblicazione sul volume “Insegnare chimica con passione” a cura della Casa editrice dell’Università di Padova ed è disponibile al seguente link
PROTOCOLLI CONSULTABILI E SCARICABILI
versione ridotta per attività di scambio in inglese
schede semplificate per far svolgere l’attività in una mostra interattiva