Studieremo insieme le molecole che si trovano dentro le cellule, quelle che caratterizzano la vita. Ma prima di iniziare a vederle in dettaglio, guardiamo insieme le caratteristiche fondamentali di alcune molecole un po’ più semplici, così quando poi metteremo insieme le parti che compongono le macromolecole sarà più facile immaginarne le caratteristiche.
Quello che vi racconto in questa pagina e su cui abbiamo ragionato insieme in classe è descritto velocemente sul vostro libro. Per ciascuno dei gruppi funzionali cercheremo adesso di capire alcune caratteristiche. Questo ci aiuterà a capire meglio le caratteristiche delle macromolecole biologiche che incorporano uno o più di ciascun tipo di gruppi funzionali.
Acqua
Per prima cosa ci siamo concentrati su una caratteristica della molecola di acqua: il fatto che il legame fra ossigeno e idrogeno è un legame covalente polare, fra l’ossigeno che è più elettronegativo (3,5) e l’idrogeno che lo è meno (2,1).

Le regioni colorate in rosso corrispondono alle zone di maggiore elettronegatività, mentre quelle colorate in verde e blu corrispondono alla minore elettronegatività.
- Poiché la molecola di acqua è polare (cioè ha delle zone parzialmente cariche + e altre parzialmente cariche -), le molecole di acqua tenderanno a disporsi fra di loro in modo tale che le regioni a parziale carica opposta siano vicine
- grazie a queste interazioni fra molecole polari l’acqua è liquida a temperatura ambiente
- e ha una notevole “tensione superficiale” ovvero le molecole dell’acqua tendono a stare fra di loro piuttosto che a interagire con quelle di un altro materiale a contatto (per questo una gocciolina versata sul banco è bella sferica, ricordate?)
Gruppi funzionali:
Carbonio e idrogeno
Carbonio e idrogeno hanno elettronegatività abbastanza simile (carbonio 2,5 e idrogeno 2,1). Le molecole che contengono carbonio legato ad altro carbonio o carbonio legato a idrogeno sono caratterizzate da legami covalenti apolari o poco polari, le molecole che ne derivano di conseguenza sono apolari.
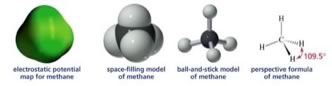 Avevamo visto ad esempio il metano che è apolare, come vedete nell’immagine a fianco la molecola è tutta verde.
Avevamo visto ad esempio il metano che è apolare, come vedete nell’immagine a fianco la molecola è tutta verde.
questa immagine di seguito vi mostra un confronto fra metano e acqua in cui si vede chiaramente che il metano è apolare e a temperatura ambiente le molecole sono distanti fra loro, infatti è un gas. L’acqua al contrario è polare, le molecole intergiscono fra di loro e a temperatura ambiente è un liquido. 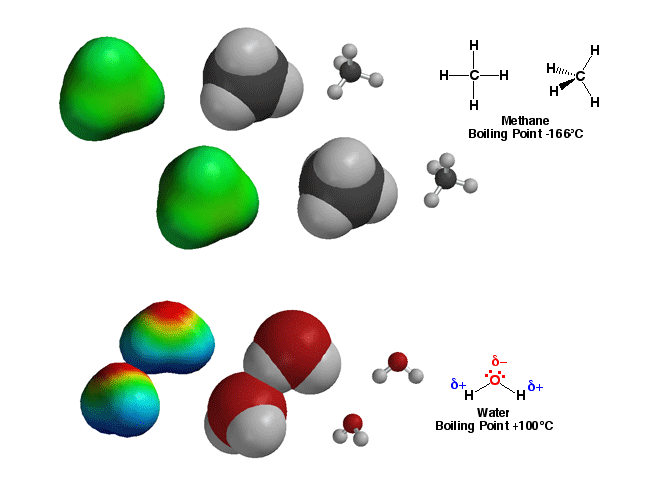 Se gli atomi di carbonio sono legati fra di loro e con gli atomi di idrogeno possiamo avere catene lineari, ramificate o cicli. Tutte molecole apolari.
Se gli atomi di carbonio sono legati fra di loro e con gli atomi di idrogeno possiamo avere catene lineari, ramificate o cicli. Tutte molecole apolari.
- Quando proviamo a sciogliere queste molecole apolari in acqua succede che l’acqua tende ad estrometterle (ricordate la tensione superficiale? le molecole di acqua “preferiscono” stare con altre molecole di acqua piuttosto che mescolarsi con molecole apolari, questo perchè ogni volta che le molecole di acqua si mettono vicine fra loro si forma interazioni intermolecolari e questo libera energia).
- Poiché l’atmosfera è ricca di ossigeno e poichè l’ossigeno è molto reattivo i legami fra carbonio e idrogeno tendono a trasformarsi in legami carbonio-ossigeno liberando energia. Tutte le molecole ricche di legami carbonio-idrogeno sono ricche di energia. Un esempio? Il metano che utilizziamo per riscaldarci, gli idrocarburi che bruciamo nei motori delle nostre auto, i grassi che mangiamo..
Alcoli
Quando il carbonio fa uno o più dei suoi quattro legami con un OH, vediamo cosa succede..
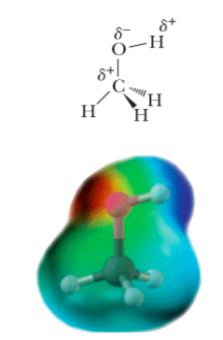
La molecola più semplice che possiamo immaginare è quella costituita da 1 carbonio, 3 idrogeni e un OH. Questa molecola, come vedete nel disegno affianco, risulta essere polare. Intorno all’ossigeno si concentra una parziale carica negativa (in rosso) mentre l’idrogeno legato a quell’ossigeno avrà parziale carica positiva (in blu). Il resto della molecola è apolare (in verde come il metano). Questa molecola che stiamo guardando si chiama metanolo e tutte le molecole che come lei hanno un OH legato al carbonio le chiamiamo alcoli.
Grazie al fatto di essere polare questa molecola potrà interagire con altre molecole uguali a lei proprio come faceva l’acqua ed in fatti a temperatura ambiente è liquida. Lo vediamo bene nel disegno qui sotto dove sono rappresentate 3 molecole di un alcol, l’etanolo, che interagiscono fra loro a temperatura ambiente.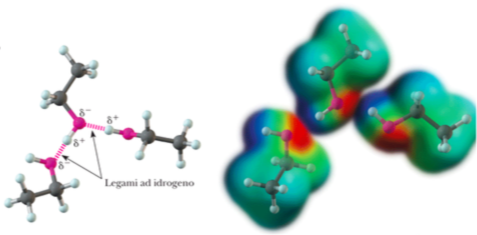
- Quando mescoliamo un alcol con l’acqua, le molecole di acqua e alcol si sciolgono insieme infatti possono tutte interagire le une con le altre grazie al fatto di essere polari.
- In una molecola di alcol ci possono essere uno o più gruppi OH. Si ottiene più energia quando l’ossigeno sostituisce l’idrogeno nel legame con il carbonio che quando sostituisce un OH, per questo gli alcoli contengono energia ma ne contengono meno degli idrocarburi. L’etanolo può essere un carburante, ma non buono come la benzina, gli zuccheri contengono molta energia, ma un po’ meno dei grassi.
Aldeidi e chetoni
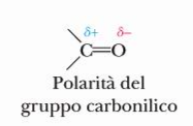 Il carbonio fa 4 legami, fino adesso abbiamo visto casi in cui il carbonio fa 3 legami con l’idrogeno e 1 con l’OH, ma il carbonio può anche fare 2 legami con altri carboni o idrogeni e due legami con una atomo di ossigeno, dando quello che chiamiamo un carbonile
Il carbonio fa 4 legami, fino adesso abbiamo visto casi in cui il carbonio fa 3 legami con l’idrogeno e 1 con l’OH, ma il carbonio può anche fare 2 legami con altri carboni o idrogeni e due legami con una atomo di ossigeno, dando quello che chiamiamo un carbonile
La molecola che risulta, come vedete dalle immagini (accanto e sotto) è polare, perchè l’ossigeno è più elettronegativo (3,5) del carbonio (2,5)
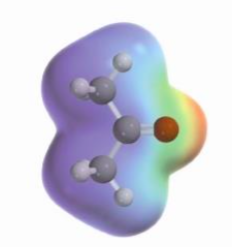
- se il carbonio è legato a 1 idrogeno, 1 altro carbonio e 1 ossigeno chiamiamo aldeide
- se il carbonio è legato a 2 carboni e 1 ossigeno chiamiamo chetone
- poichè la molecola è polare si scioglie bene in acqua
- avrà meno energia degli idrocarburi e degli alcoli (infatti negli idrocarburi tutti e 4 i legami del carbonio possono essere sostituiti con un legame carbonio-ossigeno; negli alcoli 3 dei 4 legami del carbonio possono essere sostituito con legami carbonio-ossigeno; nei carbonili solo 2 dei 4 legami del carbonio possono essere sostituiti da legami carbonio-ossigeno, mentre gli altri 2 sono già occupati con l’ossigeno)
Acidi carbossilici
Nei carbossili (il nome suggerisce carbonio + ossigeno) 3 su 4 dei legami che il carbonio può fare sono fra carbonio e ossigeno. Un esempio di molecola che contiene il gruppo carbossile è questo:
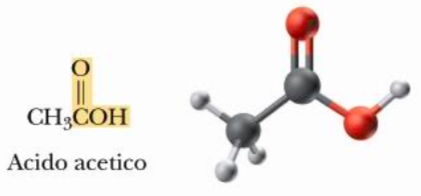
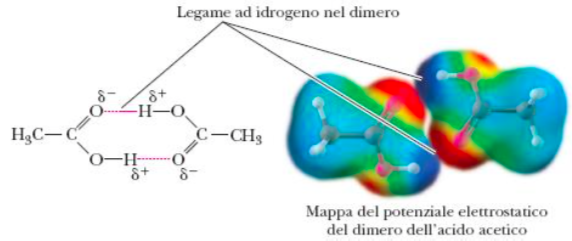
- vi ricordate l’etanolo che era CH3CH2OH, ovvero 2 carboni legati a idrogeni o altri carboni tranne in una posizione in cui c’era un legame fra carbonio e OH? Ecco abbiamo detto che quando queste molecole sono a contatto con l’atmosfera ricca di ossigeno l’ossigeno tende a sostituirsi all’idrogeno nei legami.. infatti se lasciate una bottiglia di vino aperta all’aria per un po’.. dopo un po’ diventa aceto. Infatti il nome di questa molecola è acido acetico e si tratta di una molecola di etanolo, che a contatto con l’aria, ha scambiato due legami carbonio-idrogeno con due legami carbonio-ossigeno
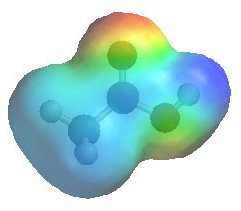 anche queste molecole come potete vedere dall’immagine sotto (e forse ormai anche immaginare) sono polari e pertanto si sciolgono bene in acqua
anche queste molecole come potete vedere dall’immagine sotto (e forse ormai anche immaginare) sono polari e pertanto si sciolgono bene in acqua- l’energia in queste molecole è davvero pochissima, 3 legami su 4 del carbonio sono già con l’ossigeno, meno energia degli acidi carbossillici la ha solo l’anidride carbonica (CO2 dove tutti e 4 i legami del carbonio sono con l’ossigeno)
Ammine
Il gruppo funzionale delle ammine è il gruppo amminico NH2. Sono molecole in cui il carbonio fa uno dei suoi 4 legami con un azoto (simbolo N) che a sua volta è legato con 2 idrogeni.
- anche queste molecole sono polari ma in questo caso nella zona intorno al gruppo amminico si ha una parziale carica positiva
Nell’immagine qui sotto vi faccio vedere una molecola che a una estremità (quella sinistra) ha un gruppo amminico, mentre all’estremità opposta (quella a destra) ha un gruppo carbossilico. La molecola si chiama ammino-acido
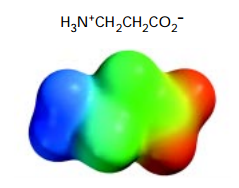
Cosa abbiamo imparato
- le molecole polari si sciolgono bene in acqua perchè possono interagire con le molecole di acqua che anche loro sono polari, basta che le porzioni delle molecole che hanno carica opposta si trovino vicine fra loro
- le molecole apolari vengono spinte fuori dall’acqua, visto che quando le molecole di acqua interagiscono fra di loro si libera energia e avere delle molecole apolari in mezzo impedirebbe questo processo
- le molecole che contengono carbonio, nella nostra atmosfera ricca di ossigeno, hanno più energia quando sono ricche di legami carbonio-carbonio e carbonio-idrogeno, perchè tendono a trasformarsi in legami carbonio-ossigeno liberando energia. Quando invece il carbonio è già legato all’ossigeno non avviene la reazione e non si libera energia
- le macromolecole biologiche sono costitute da varie dei gruppi funzionali che abbiamo visto associati fra loro in combinazioni diverse, questo conferisce alle molecole finali proprietà diverse a seconda delle combinazioni.
Un esempio di queste associazioni di gruppi funzionali diversi o abbiamo già visto sopra e si trattava degli aminoacidi, che sono i mattoncini che costituiscono le proteine.
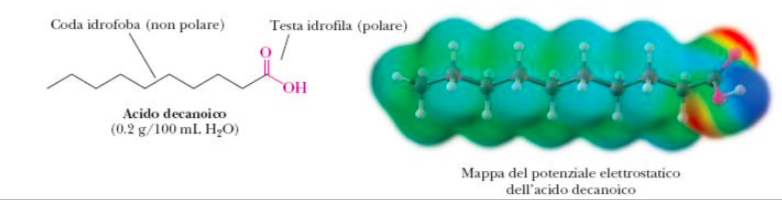
Qui sotto vi faccio vedere un altro esempio interessante di associazioni in una stessa molecola di gruppi con proprietà diverse. Vi ricordate che i grassi sono ricchi di legami carbonio-idrogeno apolari e per questo non si sciolgono in acqua? Come fa allora il sapone a farli sciogliere? Beh i saponi sono costituiti da una estremità della molecola apolare come i grassi, l’altra estremità polare come l’acuqua, pertanto interagiscono con i grassi da una parte e con l’acqua dall’altra e così facendo portano i grassi a spasso in mezzo alle molecole di acqua!
il sapone ad esempio
Cosa impareremo dopo di questo?
Ora siamo pronti per parlare delle macromolecole biologiche. Ciascuna delle grandi molecole che troviamo all’interno delle cellule è composta da diversi dei gruppi funzionali che abbiamo visto fino adesso (idrocarburi, alcoli, carbonili, carbossili e ammine) combinati fra loro a formare molecole grandi e complesse di cui però possiamo immaginare le proprietà, visto che conosciamo le proprietà delle parti che le compongono.